Fallet
Person med diabetes och allt vad det innebär, symtomen enligt nedan:
- Hyperventilerar
- Sluddrig
- Illamående och kräkts
- Trötthet
- Druckit mycket vatten
- Andas djupt och senare snabbt (hyperventilerar)
- Lågt blodtryck (95/65)
- Lågt B-pH
- Lågt B-basöverskott
- Högt Hb (177)
- Lågt P-Natrium
- Högt P-O2
- Normal SR (Sänk Reaktion)
- Lågt P-Natrium
- Normalt P-Kalium
Får koksaltslösning och injektioner av insulin. Uppföljning senare med HbA1c på högsta normalvärdet.
Studiemål
- Endokrina Pankreas
- Vilka hormoner som produceras och deras funktion, när, hur.
- Reglering
- Hormoner involverade i blodsockerreglering
- Diabetes
- Typer
- Orsak, förlopp, symptom
- Normal Kolhydratmetabolism
- Reglering
- Metabolism reglering vid fasta och föda
Kursmål
- Redogöra för hur kolhydrater, lipider och proteiner används för kroppens energiproduktion
- Förklara hur och när insulin, glukagon och katekolaminer frisätts samt deras verkningsmekanismer
- Ge exempel på hur defekter i hormonfrisättning och hormonverkan kan ge diabetes
- Förklara hur defekter i vätske-, elektrolyt- och syra-basbalans uppstår i samband med diabetes
- Förklara fettvävens roll vid utveckling av systemisk insulinresistens och diabetes
Läkemedelslista
Ingen specifik men behandling av diabetes ingår.
Tentafrågor
Sammanfattning
Pankreas
Denna PBL fokuserar på den endokrina delen av pankreas, alltså det som går ut i blodet. GI-veckan hade exokrina, det som går ut i tarmen.
Det vi kan se på den nedre bilden ovanför är Islet of Langerhans, alltså öar till Endokrina pankreas där vi har celler som utsöndrar hormoner:
- Alfa-Celler:
- Glukagon - öka utsöndring av glukos till blod
- Beta-Celler:
- Insulin - Ta upp glukos från blodet
- Proinsulin - Förstadiet till Insulin
- C-peptid - Biprodukt från klyvning av proinsulin till Insulin + C-peptid
- Amylin - Sakta ner tömning av mage
- Delta-Celler:
- Somatostatin - Hämmar processer i mag-tar kanalen och reglerar hormonutsöndring.
- F-Celler:
- Pankreatisk Polypeptid - Motverkar utsöndring av exokrina produkter
- Epsilon-celler
- Ghrelin - Stimulerar aptit
Islet of Langerhans
De langerhanska öarna kommunicerar via
- Hormonellt (endokrint): Blodflödet är inifrån och ut, vi ser att främst B-celler är i mitten. Glukagon kan stimulera Insulin, medan Insulin inhiberar Glukagon. Somatostatin är, som i föregående veckor, ett inhiberande hormon. Därför är formationen med Beta-celler och insulin som direkt når Alfa-celler (glukagon) viktig (Parakrint).
- Neuralt: Parasymatis stimulans frisätter Insulin. Sympatisk stimulans inhiberar insulin men stimulerar glukagon.
Den "karta" över hur cellerna är lokaliserade och det blodflöde som motiverar vissa funktioner, syns främst hos råttor (ser man i bild ovan). Hos människor är cellerna mer slumpmässigt utspridda.
Hormonerna
Insulin
Insulin verkar glukossänkande genom att signalera till celler att ta upp glukos från blodet. Frisätts i samband med måltid av Beta-cellen. Under fastan utsöndras också insulin, fast mindre mängd.
När insulinnivån sjunker och glukagon ökar kan oxidation, ketogenes och glukoneogenes producera glukos och ketonkroppar istället.
Större utsöndring stimulerar upptag, fettbildning och glykogenbildning, dessa kan sedan användas vid nästa fasta. Insulin och Glukagon fungerar därför som ett buffertsystem för att hålla blodsocker och energinivåer jämna.
Hjärnan, muskler och njure kan använda ketonkroppar eller glukos som energikälla, hjärtat nästan uteslutande fett. Ketonkropparna klyvs i cellerna sedan till Acetyl-CoA som då kan nyttjas som energi.
Insulin bildning
Preproinsulin (mRNA) -> Proinsulin (rER) -> Insulin + C-peptidi Golgi till Vesikel.
C-peptid används kliniskt för att bestämma hur mycket insulin som tillverkas. Det mesta (60%) av Insulin som går genom levern bryts ner där, därför mäter man C-peptid, som går ut genom urinen istället. Insulin har dessutom en halveringstid på 6 minuter och är därför i princip rensat ur kroppen efter en kvart.
Glukagon
Har den motsatta effekten av Insulin och frisätts istället när vi har lågt blodsocker (t.ex. fasta) för att frigöra energi från lever och fett. Kommer från Alfa-cellerna.
Blodglukos
Normalt friska personer har en väldigt reglerad glukosnivå i blodet även efter stort intag socker eller fasta under natten.
Ger man glukos intravenöst istället för genom kosten, blir Insulinsvaret något annorlunda då det kort därpå (minuter) ges ett akut svar (lagrat insulin i Beta-cellers vesiklar) och sedan ett långvarigt (nytillverkning) tills glukosnivåerna är normala i blodet igen.
Får man i sig glukos via os (oralt) så sker upptaget gradvis i tarmen och då får man inte akut-fasen.
Diabetes Mellitus
I vardagligt tal Diabetes och vanligaste metabola sjukdomen.
Tillstånd av hyperglukemi som kan förorsakas av såväl livsstils- och miljöfaktorer som ärftliga faktorer. Hyperglukemi kan orsakas av insulinbrist eller faktorer som motverkar insulinets effekt.
Diagnos ställs utifrån:
- Glukoskoncentration i fasta (f-p-glukos)
- Mängden glukos i blodet efter Glukosbelastning (dricker lösning)
- Långtidsglukos (HbA1c) - Glukos påverkar vårt Hb och ger ett fingeravtryck på långtidseffekten.
Typer av diabetes
"Primär" diabetes (98%)
Typ 1 och Typ 2, dessa har undertyper och blandformer med. Alltså det vanliga, samtidigt som det är samlingsnamn för flera olika typer.
Sjuka i Typ 1 diabetes utsöndrar inte insulin vid svar på blodsocker höjning, vilket ger höga värden under längre tid (kan mätas i HbA1c med).
Vi test av Diabetes kan man ta glukos intravenöst och där uteblir då akutfas-utsöndringen av insulin, tömningen av Beta-cellers vesiklar.
Sekundär diabetes (2%)
- Graviditetsdiabetes
- Alkoholinducerade (Pankreatogen),
- Endokrina sjukdomar (överproduktion av t.ex Kortisol, Ketokolaminer, GH).
- Läkemedelsorsakad diabetes (Kortison)
Typ 1 diabetes - Diabetes Mellitus
Orsakas av autoimmun nedbrytning av B-cellerna som utsöndrar Insulin. 15% av all diabetes och behandlas med insulin.
- Brist på insulin och sedan Glukagon ger ökad mängd ämnen i blodet.
- Högre nivå ketonkroppar och osmos i blod (och urin = kissar mycket)
- Ketonkroppar ger metabol Acidos och kan vara dödligt.
Det normala är att få det i barndomen och upp till 10-15 år ålder är antal insjuknande fler. Man kan få det även i vuxen ålder men antalet ligger stabilt efter 30 års ålder.
Insjuknandet sker när någon autoimmun del angriper kroppens B-celler på grund av virus, infektion eller annat.
Typ 2 Diabetes- Diabetes Mellutis
Sjuka i typ 2 diabetes har färre Insulin-receptorer och därför mindre känsliga mot insulin.
Inte autoimmun utan kan vara klassiskt att det kommer efter 40 års ålder men gå ner i åldrarna. Är 55% av all diabetes.
Det kan även vara en monogen nedärvning (MODY - Maturiry Onset Diabetes in the Young), som då kommer runt 15-25 års ålder. 10% av fallen.
Finns variationer av mixad genetiska och latenta autoimmuna diabetes som då liknar typ 1 och går långsamt. 10% av fallen.
Man får här högre risk för högt blodtryck, fetma och då arteroscleros. Genom noga kontroll av blodvärden kan man fördröja utvecklingen något.
Det som händer är att Beta-cellerna försöker kompensera genom att öka sin utsöndring och produktion av Insulin. När detta sker går protein-produktionen till slut på max och risken för fel ökar. Vid protein-fel kommer UPR systemet (Unfolded Protein Response) att sparka in för att skydda cellen från felveckade proteiner. Klarar cellen inte av detta går den in i Apoptos och då försvinner tillslut Beta-cellerna.
Man får aldrig ketonkroppsutveckling vid denna typ av diabetes eftersom den mängd insulin som faktiskt finns, räcker för att förhindra lipolys (nedbrytning av fett i stor mängd), även om det inte kan normalisera glukoshanteringen. Det är fettet som bildar ketonkroppar vid överdriven förbränning.
Kortisol
Kortisol utsöndras mer som en del i stress och minskar insulinets effekt, vilket leder till högre glukosnivåer i blodet. Fettmetabolism kan även påverkar och därmed högre nivå fria fettsyror. Omfördelningen av fettet kan därför leda till inlagring i bukhålan (äppelfettma). Som en förlägning på detta kan övervikt, fetma och utveckling av metabola syndromet ske. Som avslutning kan det då bli typ 2 diabetes.
Det kortisol gör är att inhibera Insulin så att man hindrar glukos från att spara och istället kunna användas. En rimlig respons i fight-flight.
Graviditetsdiabetes
Moderns känslighet för insulin sjunker och det kräver att Beta-cellerna kompenserar, vilket inte alla personer klara av (3%). Större problem återfinns i Asien ,Nordafrika och Mellanöstern. Detta blir sedan spontant bättre efter födsel (postpartum), men ger även en signal om ökad risk för Typ 2 diabates senare i livet.
Mammans insulinkänslighet sjunker, vilket leder till högre glukosnivåer. Barnet kommer då behöva producera mer insulin och detta leder till fett och organtillväxt (Microsomia).
Progesteron (kortiol, tillväxthormoner hPL osv) utsöndras för att se till att barnet får föda. Normala responsen för Insulin fungera inte heller, då samma hormon kommer minska dess känsligheten.
Barnets Insulinnivåer kommer öka och barnet kommer att växa mer och modern får de fyra P:
- Polyuria (överdriven urinmängd)
- Polyphagia (överdriven hunger)
- Paraesthesia (domningar)
- Polydipsi (törst)
Fetma kopplat till diabetes
Flera mekanismer gör att just dålig kosthållning och fetma är en riskfaktor att utveckla just typ 2 diabetes.
- Oreglerad fettmetabolism ökar mängden fria fettsyror i cirkulationen och därför upptag och lagring i andra celler.
- Ändrade mängder av fettcellshormoner kommer som konsekvens av mycket fett och fettceller.
- Inflmmation och makrofager ger störningar vid cellerna, foam cells Oxitativ stress.
Dessa tre gör det svårare för kroppen att hantera insulinet och nå receptorerna i vävnaden.
Kroppen kan kompensera insulinresistansen genom att öka kravet på Beta-cellerna att producera mer insulin, då blir man överviktig och frisk (tills vidare).
Vi får även ändrad svar vid inbindning av insulin till Tyrosinreceptorn. Vi får istället Serin/Teroininkinaskastakder, vilket inte ger något GLUT4 till membranet och därför inget glukos in i cellen.
Utvecklingsstadier
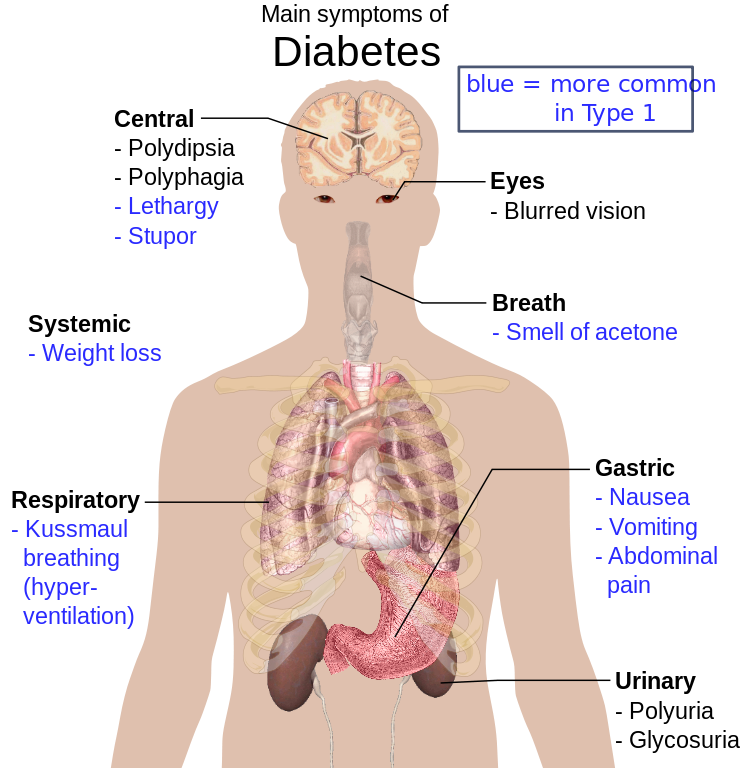
Beroende på vilken typ av diabetes man har så får man olika utvecklingsstadier. Diabetes typ 2 når inte samma farliga nivåer som typ 1. Vid typ 1 får man alltså en kraftig metabol acidos som delvis försöker kompenseras genom respiration.
Stegen ser ut som:
- Koma
- Acetonlukt - Ketonkroppar
- Hyperventilation - Motverka Acidosen i kroppen
- Buksmärtor
- Lågt blodtryck
- Intorkning
- Viktnedgång
- Polyuri - Osmos i urin ökar
- Törst - Pga ökade osmos och mer vatten drivs ur kroppen
- Trötthet - Minskat ATP då glukosförbränning inte sker
Beta-celler och Insulinutsöndring
Beta-celler tar upp Glukos, Galaktos och Mannos som ger upphov till utsöndring av Insulin. Kan det inte metaboliseras, ger det inget insulinsvar. Även vissa ketonkroppar, fruktos och peptider ger visst svar, då de metaboliseras i citronsyracykeln. Frisättningen beskrivs nedan.
- Glukos in i cell via GLUT2 kanaler (okänsliga för insulin)
- Glukokinas (lever och pancras specifik) hexokinas gör om Glukos till Glukos-6-fosfat och får ut ATP från glykolysen.
- ATP bereonde K+ kanaler stängs.
- Beta-cellen depolariseras
- Ca2+ kanaler triggas av spänningsändringen.
CCK stimulerar även detta steg genom annan signalväg.
- Ca2+ strömmar in, samt ER frisätter Ca2+
- Calmodulin fosforyleras och Insulinvesiklar töms från cell till blod.
Här kan Glucagon och Beta-Adrenerga-agonister stimulera yttelrigare (modulera)
Somatostatin kan även inhibera här.
Glukagon stimulerar systemet, medan Somatostatin inhiberar. Glukagon går förbi systemet och kräver ingen glukos för att stimulera insulinfrisättning.
Alfa- inhiberar och Beta stimulerar. Vid sympatiskt utsöndras Noradrenalin av Postganglion synapsen och dessa ska då inhibera vid sympatiskt påslag. Vi vill ha mer glukos i blodet när vi flyr.
Vid tester har man sett att Insulin utsöndras mer om man intar glukos via föda istället för intravenöst. Detta kopplas då till nerver som kan stimulera frisättning redan när man har det i munnen. CCK och GIP som utsöndras under digestionen stimulerar frisättning av Insulin.
GLP-1 (Glucagon-Like-Peptide-1) utsöndras av Ileum/Colon vid födintag och stimulerar även det insulin. L-celler. Detta är varför vi får större Insulinutsöndring när vi tar föda via tarm än direkt i blod (samma mängd glukos). GIP-1 ingår tillsammans med andra i en grupp av hormoner som kalla Incretiner! Som alla utsöndras på det sättet från tarmen.
Insulin påverkar fett, lever och muskelceller (glukagon påverkar inte muskel).
Katekolaminer förändrar även hur utsöndringen sker genom andra receptorer på membranet:
- Acetylkolin: Stimulerar likt CCK
- Beta-Adrenergisk agonist, stimulerar likt glukagon
- Alfa-Adrenerisk-agonist inhiberar likt somatostatin.
Insulins påverkan i kroppen
Insulin påverkar främst
- Hepatocyterna i levern - För inlagring av glukos till glykogen
- Skelettmuskler - För upptag och lagring av energi
- Fettväv - För upptag och lagring som fett
Eftersom blodet från Pankreas färdas genom levern kommer Hepatocyterna först att ta emot insulinet och påverkas av det. När Insulin når målorganen så binder det till Tysroinkinasreceptor och leder till kaskad enligt ovan.
Vi har en överkapacitet av receptorer och normalt används bara ca 5% hos cellen för att ge svar. Cellerna kan dock styra sin nedbrytning och syntes av receptorer för att göra sig mer eller mindre känslig. För att minska risken för typ 2 diabetes vill man öka mängden, t.ex. genom träning och bra kosthållning.
Hepatocyternas reaktion på Insulin
Hepatocyterna hos levern står för lagring av glykogen som då sker när vi har högt glukos i blodet, alltså när vi utsöndra Insulin. Glukos tas in genom GLUT2 receptorn (insulin oberoende). Glukoset kan antingen nyttjas som energi i cellen eller bilda Glykogen genom Glykogenes. Hepatocyterna saknar GLUT4 (har GLUT2 istället), och Insulin påverkar istället genom att starta processerna nedan. Detta genom:
PEPCK (Phosphoenolpyruvate carboxykinase): Stoppar hastighetsbegränsande steget i Glyconeogenesen. och G6P (Glucose-6-Phosphatase): sista steget i Gluconeogenesis, som skapar Glukoset.
- Glykogensyntes - Vilket även minskar nedbrytnign av glykogen (vi vill inte ha båda samtidigt) - Glykogenes.
- Glykolys - nedbrytning för bildande av pyrovat
- Lipogenes - Bygga upp fettsyror som kan lagras och utsöndras som VLDL, alltså minskar vi även fettnedbrytningen (åter igen vill vi inte ha både och igång)
- Proteinsyntes - Hindra nedbrytningen av protein eftersom vi vid överskott av energi kan använda protein till uppbyggnad istället för reserv som energi.
Skelettmuskulaturens reaktion på Insulin
Konceptet är samma som i leverns Hepatocyter, vi vill ta vara på energin och lagra den, samtidigt som vi inhiberar de motsatta systemen.
- Rekrytera GLUT4 (insulinkänsliga) kanaler till membranet, vilket ökar glukosintag
- Glykogensyntes - Producera mer glykogen och minska nedbrytningen av den.
- Glykolys - Bryta ner glukosen till energi
- Proteinsyntes - Ökar protein-byggande och då inhibera nedbrytningen.
Adiopocyters reaktion på Insulin
Fettvävnader har även här liknande funktion som hos muskel och lever-celler. Vid hög nivå Insulin vill vi lagra energi i form av fett, vid lågt vill vi släppa ut energi (bryta ner fett).
- Rekrytera GLUT4 (insulinkänsliga) kanaler till membranet, vilket ökar glukosintag
- Glykolys - Bryta ner glukosen till energi så de kan bygga upp fett (lipogenes)
- Lipogenesen - Stimulera bildande och lagring av fett
- Syntes av lipoproteinlipas (LPL) - Detta sätter sig i blodet endotel och är det enzym som bryter ner Chylomikronerna och VLDL till Glycerol och fett (så celler kan ta upp det).
Alfa-celler och Glukagon
Glukagon utsöndras och bildas av Alfa-cellerna som också finns i Pankreas. Glukagon genomgår liknande omvandling som Insulin med klyvningar och från Proglukagon till Glukagon + andra peptider (GRPP och Major Progulcagon Fragment).
Glukagon aktiveras och utsöndras från vesiklar (precis som insulin), vid stimulans från aminosyror och Glukagon sen stimulera leverns funktioner som:
- Glykogenolys - Nedbrytning av Glykogen till glukos
- Glukoneogenes - Bildande av glukos från andra substrat (laktat t.ex.)
- Ketogenes - Ketonbildning av fett
Glukagonets frisättning inhiberas av Glukos (som också stimulerar Insulinfrisättning). Äter vi en kolhydrat-fattig måltid med proteiner, kommer vi stimulera både Insulin och Glukagon. Glukagonet balanserar dock upp detta genom inhibering av Insulinets inverkan. Vi skulle annars får lågt blodsocker också insulin som minskade det ytterligare.
Glukagon påverkar lever och fettvävnad men inte muskler (som Insulin gör).
L-Celler
I tarmen har man sedan även L-celler som producerar GLP-1 (Glucagone Peptide like hormone 1) som stimulerar utsöndring av insulin.
L-cellerna använder samma ursprungsgen för att skapa GLP-1 men har andra proteaser som klyver och får därför ut GLP-1 istället för Glukagon, vilken stimulerar frisättning av Insulin.
Insulins och Glukagons interaktion
När vi är i fasta är insulin lågt och glukagonet ökar. Detta så att levern kan frigöra glykogen och ge kroppen glukos. Med detta kan kroppens blodsocker hållas reglerat både under måltid och fasta.
Minskar blodglukos kommer Beta-celler känna av det och insulinproduktionen minska, samtidigt som Alfa-cellerna ökar glukagonen.
Vid längre fasta stimuleras även lipolys (fettnedbrtyning) och proteolys (proteinnedbrytning), så att vi kan förse kroppen med energi. Fettnedbrytningen kommer leda till ketogenes, och acetondoften vid strikt LCHF diet.
Om en diabetiker inte behandlas kommer blodglukoset att öka, samtidigt som cellerna inte kan ta hand in det och nyttja. Detta betyder att cellerna nu istället börjar bryta ner, glukagon-effekten, som leder till utsöndring av aminosyror och fett till blodet, vilket stimulerar glukagon frisättning (aminosyror). Resultatet blir Glukosuri, vilket gör att glukos kommer utsöndras via urinen och med det högre osmos, dra med sig vatten. Vattnet drar till sig Na+, som sedan ska resorberas i utbyte mot K+, därför får vi även K+ brist.
Denna brist uppstår dock inte i fallet eftersom vi har H+/K+ pumpar som försöker göra sig av med syran (acidos) i blodet. Därför har vi ett neutralt eller överskott av Ka+.
Personen behandlas dock ändå med K+ eftersom totala kropps-K+ är lågt medan det är högt i blod. När man behandlar med Insulin kommer cellerna ta upp Kalium igen och då sjunkar P-kalium och leder till hypokalimi.
Delta-celler och Somatostatin
Somatostatin är hormnet som inhiberarde alla de processer vi hade i GI-veckan, och inhiberar även utsöndring av insulin, glukagon, gastrin osv.
Den anatomiska uppdelningen med delta-celler ytterst, beta-celler (insulin) innerst och blodflödet som går inifrån och ut i de langerhanska öarna, gör att de inte inhiberas så kraftigt.
Ketoacidos
Om man har obehandlad diabetes kommer fett börja brytas ner eftersom fettcellerna inte känner av insulinet. Detta kommer ta sig till levern som fria fettsyror och börja förbrännas. Vid denna förbränning bildas nu Ketonkroppar och släpps ut för att ge hjärnan näring. Hjärnan är dock inte beroende av Insulin för att ta upp glukos, så ketonkropparna behövs egentligen inte. Vi får istället Ketoacidos.
Typ 2 diabetiker kan ha mer avvikande glukosnivåer utan ketoacidos eftersom fettcellerna är mer känsliga och börjar därför inte bryta ner fettet trots sjunkande Insulinnivåer.
Typer som utsöndras
- Acetoacetat, kan bil någon av de två andra sen.
- Aceton
- β-hydroxybutyrate
Glukos och Födotillstånd
Leverns funktion är att hjälpa kroppen hålla en jämn nivå av glukos i blodet. Insulin signalerar att vi har mycket glukos och att levern ska lagra det till Glykogen och fett. Glukagon fungerar motsatt vad Insulin gör, så det signalerar fasta medan Insulin signalerar flöda.
Glukagon stimulerar:
- Glykogenolys (Glykogen till Glukos)
- Glukoneogenes (Laktat, Glycerol och Aminosyror till Glukos
- Ketonsyntes (Fett till Ketoner för att använda istället för glukos, t.ex. hjärnan)
Leverns funktion är att vi överskott av Glukos ta upp detta via GLUT2 (insulinoberoende kanaler) och omvandla t.ex. Galaktos och Fruktos till Glukos. Överskottet blir triglycerider (VLDL). Att ta emot Alanin och frisätta det som glukos till kroppen och omvandla fett till ketoner.
Födotillstånd mätt (Absorptionsstadiet)
Här är det Insulin som är det viktiga signalhormonet och utsöndras precis som Glukagon av Pankreas.
Har vi ätit kommer kroppen att få i sig massa glukos, fett och aminosyror. Glukoset kan användas av alla vävnader och levern komma lagra in det som glycogen eller överskott som Triglycerider (fett) och det går ut som VLDL till kroppen (fettceller).
Det är Glukos som går till pyruvat -> Acetyl-CoA som kan bilda triglycerider. Triglyceriderna formas i Lipoproteiner för transport till fettcellerna från levern. Fettcellerna kan ta emot glukos direkt för lagring med.
- Glukos är hjärnans huvudsakliga energikälla (ketonkroppar när vi får brist).
- Fett tas upp och färdas som Chylomikroner via lymfan till venösa blodet (Angulus Venosus).
- Insulin stimulerar även upptag av aminosyror till levern.
Förlopp
- Lagring av överskottsenergi
- Glukos öden:
- Energiproduktion
- Glykogen i lever och muskel
- Omvandling till fett
- Glukos lagras som triglycerider
- Aminosyror används som aminosyror
GLUT-2 är ett insulinoberoende glukosupptag.
Vi lagrar upp glukos till glykogen och när den reserven är fylld kommer det bli triglycerider (VLDL) till blodet till lagring i fettvävnad.
Aminosyror som inte kan användas omvandlastill a-ketosyror till fettsyror för energi eller larging (VLDL).
Födotillstånd fasta (Post-Absorptionsstadiet)
När vi inte har innehåll i mag-tarm som tillförs utan förlitar oss på de lager av energi som vi har. Triglycerider i fettvävnad, glykogen i muskel och lever.
Tre processer sker, i olika grad beroende på hur långt man gått
- Glykogenolys (Glykogen -> Glukos till blodet)
- Glukoneogenones bildas (från laktat, glycerol, aminosyror) och blir sedan glukos
- Ketonsyntes från fettsyror som går till vävnader för energi. Denna tar lite längre tid och det som luktar aceton när man inte får i sig kolhydrater.
Alpha-Celler i Pankreas utsöndrar Glukagon, dessa påverkar inte Skelettmuskler eftersom de inte har receptor för det. Fettceller har istället och det stimulerar till frisättning av nedbtyning av fett ill Glycerol och fria fettsyror. Detta kan levern ta upp och omvandla till ketonkroppar (fett) och glukos (glycerol) som kan nyttjas av t.ex. hjärna och muskler.
Levern kan även bryta ner proteiner för att frisätta Glukos. Skelettmuskler kan även de utsöndra aminosyror vid fasta, men detta är inte beroende av glukagon (då receptorn saknades).
Vid tillstånd av fasta kommer i början glukos-nivåerna att sjuka i blodet medan fettnivåerna ökar.
Det är ketonkropparna som bildar aceton som luktar vid strikt LCHF. Hjärnan nyttjar normalt bara glukos och kommer att i reserv omvandla ketonkroppar till Acetyl-CoA, inte använda fett direkt.
Ökningen av Ketonkroppar kommer inom en vecka att överstiga glukosnivåerna i blodet.
Behandling av Diabetes
För båda typer är det bra att få koll på nedanstående genom att man försöker behandla och lindra symptomen via bättre kost och livsstil:
- Energibalanserad, fettbaslanserad och fattig på kolhydrater.
- Fysisik aktivitet bidrar positivt genom sänkt B-Glukosoch ökar insulinkänsligheten och minskar risk för hjärt/kärl sjukdomar.
- Insulin - Subkutant eller pump
- Eventuellt får man reglera blodtryck och blodfetter med
Typ 1 Diabetes
Man tittar på framtida behandlingar med transplantation av pankreas-öar eller b-stam-celler. Annars är det Insulinbehandling som gäller.
Typ 2 diabetes
Mer komplex och har både med miljö och arv att göra, men här gäller det att med grundbehandlingen av kost och motion öka känsligheten för insulin igen och minska fettmängden som stör upptaget.
Det finns flera farmaka man kan använda om det krävs ytterligare hjälp:
- Akarbos: Bromsa glukosupptag från tarm
- Empagliflozin: Öka glukosutsöndring via njurarna
- Metformin/Troglitazon: Öka insulinkänsligheten
- Sulfonylurea: Stimulerar insulinsekretion
Tillslut drabbas alla med typ 2 diabetes av sekundärsvikt, alltså att alla Beta-celler brunnit ut, då behöver man Insulin.
Risker med diabetes
Makroangiopati - storkärlssjukdom i artärer som leder till samma slags Atheroskleros som vid annan hjärthjärlsjukdom.
Mikroangiopati - Småkärlssjuka i arterioler, diabetesspecifikt. Detta kan leda till specifika problem med blödning, näthinneavlossning och tillslut då blindhet (Retinopati). I annat fall kan man få nedsatt njurfunktion och Uremi (urinförgiftning), vilket kräver dialys eller njurtransplantation.
Neuropati och ddiabetiska fotsår är vanligt också, där man får nedsatt blodflöde, ödem och känsel i fötterna. Riskerna med detta är att man inte känner av när man skaver emot och får sår, vilket sedan förvärras då det blir svårt att läka med dålig cirkulation och då sämre immunsvar.
Akuta diabetessymptomen
- Ingen
- Hyperglukemo: Trötthet, Polyuri, törst (både typ 1 och 2)
- Ketoacidos: Illamående, Hyperventilation och kan bli Koma vid Typ 1
- Vid insulinbehandling kan man få Hypoglykemi som ger stresspåslag, blekhet, agressivitet och förvirring. Kan även ge Koma, gäller både Typ 1 och Typ 2 diabetes.
Shock
En person som får ett sjunkande blodsocker (överdoserat insulin så cellerna tar upp för mycket) kommer det att vid en viss nivå hamna i shock med kramper och tillslut koma. Detta är svårt att skilja från samma tillstånd som sker om glukosnivåerna är höga (insulin inte fungerar eller tas). Skillnaden är att om Insulinnivån är låg och personen har för mycket glukos, kommer där vara Acidos som ger symptomen som hyperventilation och acetondoft!
För att komma undan detta kan glukos ges intravenöst eller glukagon/adrenalin för att få levern att utsöndra glukoset om orsaken är hypoglykemi.
Farmakologi
- Akarbos: Bromsa glukosupptag från tarm, minskar upptag av disackarider.
- Empagliflozin: Öka glukosutsöndring via njurarna
- Metformin/Troglitazon: Öka insulinkänsligheten
- Sulfonureider : Stimulerar insulinsekretion
- GLP-1 analog: Stimulerar Insulinsekretion och hämmar glukagonsekretion, samt minskar aptit.
- DPP4 hämmare: Ökar kroppsegna GLP-1 genom minskad nedbrytning från DPP4.
- Insulin: Istället för det beta-cellerna producerar kan man ta Insulin som kompensation.
Fettvävnad
Vi har olika typer av fettvävnad (vit, beige och brun). Dess funktioner är att lagra energi (triglycerider) efter måltid, frisätta energi (fettsyra) mellan måltider och att frisätta hormoner (adipocytokiner).
Vita fettceller är sådana som generellt lagrar mycket fett som energi medan de bruna är sådana som typiskt använder UCP (UncouplingProtein), som bildar värme. Detta görs genom att gå förbi ATP-steget i elektrontronsportkedjan och istället "kortsluta" för att ge värmebildning.
De vita cellerna innehåller en stor droppe fett medan de bruna har flera små och är mer järn-rika (därav färgen). Bruna har generellt mer kapillärer, så de kan få syre och sprida värme till kroppen.
Vi har ganska lite brunt fett och det blir mindre med åren. Den vita fettväven kan bli brunar "browning" och blir då mer beige.
Hormoner från fettvävnaden
Fettvävanden frisätter olika hormoner, som Cytokiner (Adiopocytokiner) och Leptin.
Leptin frisätts från fettvävnande som ett mått på hur stort energiförrådet är .Det når hjärnan och hypothalamus och samverkar i andra delar av hjärnan med dopamin för att reglera hunger och mättnad. Hos möss har det även visat sig aktivera sympatiska nervsystemet och termoreglering i bruna fettceller.
Adipocytokiner (Leptin, IL7, TNF-a, Resistin, Apelin, Irsin) utsöndring och storleken på fettcellerna har ett samband. Större fettceller utsöndrar mer av dessa cytokiner av den inflammatioriska sorten och de små mer av antiinflammatoriska. Man kopplar dessa nivåer till metabol syndrom och insulinresistens.
Förhöjda nivåer av fria fettsyror i cirkulationen leder till oxidativ stress och ett immunsvar. Där bildas sedan foam-cells som stör omgivande celler och dess insulinkänslighet.
Fallet
Personen hade högt glukosvärde vilket leder till högre osmos i blodet och mer vatten stannar kvar i njuren. Detta ihop med Acidos, alltså överskott av H+, ger ett större utbyte av H+ mot K+ i njuren som då gör att Kalium-mängden minskar.
Acidos uppstår enbart vid typ 1 diabetes eftersom vid typ 2 har vi fortfarande insulinproduktion, bara större tröskel. Mängden Insulin räcker för att förhindra att fettceller friger den mängden fettsyror som orsakar ketoacidos.
Eftersom vi har högre osmos och gör oss av med mer vatten, kommer vätskenivån i kroppen minska. Vi blir törstiga och ADH nivåerna stiger. Detta ger oss även sänkt blodtryck, som försöker kompenseras med högre puls (Takykardi).
Mer vätska i njuren betyder även mer urin och behöver gå på toaletten mer, Polyuri.
När blodet koncentreras på grund av minskad vätska, ser vi även minskad SR och ökad Hb. RAAS systemet kommer aktiveras här med.
Personen får KCl tillskott trots överskott av Kalium eftersom när Insulin sparkas in i blodet kommer K+ att tas upp av cellerna och leder snabbt till minskat kalium i blodet!
Adrenalinet och Glukagonet som frisätts kommer att stimulera att processer som ser till att vi får ut energi i kroppen.
- Lipolys
- Proteolys (skelettmuskulatur)
- Glykogenolys
- Glukoneiogenes
- Ketogenes
Bonus