Fallet
Urinvägsinfektion som börjar med besvär vid miktion och att urin luktar illa. Två dagar senare uppstår smärta i höger flank (sida) och tilltagande feber med frossa.
Värden
|
Värde
|
|
Kommentar
|
|
Temp
|
40.1C
|
Högt
|
|
Blodtryck
|
95/60
|
Lågt
|
|
B-Hb
|
148
|
Normal
|
|
B-LPK
|
15x10^9/L
|
Högt
|
|
P-CRP
|
205 mg/L
|
Högt
|
|
SR
|
75
|
Högt
|
Urinsticka
|
Nitrit
|
pos
|
|
Vita
|
3+
|
|
Erytriocyter
|
3+
|
|
Glukos
|
0
|
Behandling
Som behandling ges bredspektrun-antibiotikum och odling visar tillväxt av Gram-negativ Enterobakterier i blododling. Samma som i urinen, vilket talade för Urosepsis.
Studiemål
- Hur kan man ha urinvägsinfektion utan feber? (Om svaret dyker upp)
- Repetera
- Medfödda immunförsvaret (Stanna vid Lymfan)
- Inflammation
- Komplementsystemet
- TLR - Toll Like Receptors
- Bakterier (Översikt, Generellt)
- Typer
- Klassificeringar
- Tillväxt / Liv
- Virulensfaktorer
- Antibiotika
- Urosepsis
- Förlopp (Infektion till Sepsis -> Vad händer?)
- Symtom
- Behandling
- Virulens
- E-coli
- Dess försvar mot immunförsvaret
- Förklara värdena i fallet
Viktigt
Denna del MÅSTE man kunna till tenta. Det är från min slutsammanfattning.
Sammanfattning
Blodceller
Kan delas in i Röda (Erytrocyter), Trombocyter (blodplättar) och Vita (Leukocyter).
Leukocyter kan delas in ytterligare:
- Polymorfonukleära celler (Neutrofiler, Basofiler, Eosinofiler och Masceller)
- Lymfocyter
- Dendritiska celler / Monocyter (i blod) -> blir Makrofager (eller andra typer) i vävnad.
B och T-celler är inkluderade i det inlärda (adaptiva) immunförsvaret, medan de andra är del av medfödda immunförsvaret. NK och T-hjälpar-celler är en del av båda.
Neutrofilen
- Dödar
- Bryter ner
- Äter upp
- Har kort livstid, ungefär timmar till 1 dag.
Kroppens barriärer
Kroppen har en barriär som gör det svårare för främmande substanser att ta sig in i kroppen och orsaka skada. Det andra är kroppens försvar i form av antimikrobiella proteiner och fagocyter, som man får en indikation om att det nås genom inflammation. Dessa kan man räkna till det medfödda immunförsvaret.
- Syror: Huden, magsäck, vagina osv har syror som ger skydd mot bakterier och en ogästvänlig mijö.
- Enzymer: Lysozymer, Pepsiner m.f som finns i saliv, mage, mucus, tårar förstör bakterier.
- Mucin: Bildar ett tjockare slem som gör att bakterier fastnar och transporteras till t.ex. magen
- Defensiner: Är antimikrobiella peptider, går ens yttre barriär (som hud) sönder, ökar utsöndringen av dessa.
- Normal bakterieflora: Bakterierna måste konkurrera mot andra bakterier som lever i symbios med kroppen.
Bakterier som vill ta sig in måste helt enkelt komma via insekter (förbi huden), hålla sig fast på slemhinnor via adhesiner och motstå antibakteriella peptider (Defensiner).
Immunförsvaret
Celler funktioner
NK celler: Anti-tumör och anti-virus
Eosinofila/Basofila: anti-parasiter
Neutrofiler: Granulocyter, fagocyterar
Monocyter: Makrofager/dendritiska, APC, fagocyterar
Mast-celler: Anti-parasitiska maskar
|
Neutrophils
|
60–70%
|
|
Basophils
|
0.5–1%
|
|
Eosinophils
|
2–4%
|
|
Monocytes
|
3–8%
|
|
Lymphocytes
|
20–25%
|
Medfödda immunförsvaret
PAMP (Pathogen-Associated Mlecular Patterns) / PRR (Pattern Recognition Receptors) ska känna igen sekvenser som är gemensamma även om man patogenen ändrar sig ofta. Molekylerna som känns igen är sådana som är bärande och svåra att variera för mirkoberna. TLR (Toll-Like Receptors) är en typ av sådana receptorer och t.ex. IL (interlukiner) skickas ut som svar.
IL - Svar kan ta upp till 4h om det måste produceras innan det skickas ut. Vissa celler/platser har IL lagrat i vesikel och kan då avge det direkt.
PRO-inflammationspartiker (TNF, IL-6 och IL-1) gör att
Mer genomsläpplig av plasma (med antikroppar osv)
Klibbigt för leukocyter som ger att tillströmning av neutrofiler (först) och sedan Monocyter/Lymfocyter
IL-8 är den cytokin som är en kemotaxisk faktor för neutrofiler och den som får dit dem.
När koncentrationen av Cytokiner är högre kommer ICAM-1 att uttryckas på membranet, vilket gör att Leukocyter binder till hårdare och därför sker en migration ner i vävnaden. Detta hjälper migrationen ner till den plats som behöver immunförsvaret.
TLR - Toll Like Receptors
Dessa receptorer hittas på celler hos det medfödda immunförsvaret och sitter i dess plasma membran, både på insidan av cellen (kärna, intracellulär vätska) och mot utsidan (intracellulär vätska). Det finns runt 10 olika hos människor, och de är specifika för vissa mönster (RNA/bakterier/Svamp). Ett av dessa mönste är LTS som kommer från Grampositiva bakterier. TLR kan bilda dimerer med varandra beroende på vad de ska upptäcka.
Extracellulära
- TLR 1, 2, 6: Bakteries lipopeptider
- TLR 2: Batkeriers peptidoglykaner
- TLR 4: Lipopolysakarider (LPS)
- TLR 5: Flagellin (Flageller)
- TLR2 och TLR-6: Diacyl lipopeptides - Gram positiva
- TLR-2 och TLR-1: Triacyl lipopeptides - Gram positiva
Intracellulära (Endosomala)
- TLR 3: dsRNS (Double stranded) -Virus
- TLR 7, 8: ssRNA (Single Stranded) - Virus
- TLR 9: CpG DNA (Ometylerat oligonukelotider) -Virus/Bakterie
När dessa TLR aktiveras kommer en kaskad av händelser ske:
AP-1 (Activator Protein 1)
Går in i cellkärnan och aktiverar transkription för protein som aktiverar cellsignalering.
IRF (Interferon Regulating Factor)
Går in i kärnan och aktiverar transkription för Interferoner.
NfkB (Nuclear factor kappa B)
Går in i kärnan och aktivera gener för att skapa Proinflammatoriska cytokiner och driva till inflammation.
Pro IL-1B -> IL1B
Pro IL-18 -> IL-18
Dessa två "pro" är inaktiverade och aktiveras först när de kommer i kontakt med enzymer för Caspase-1. Dessa kommer då öka immunrespons och Lymphocyte aktivering som kemotaxi.
TNF-a och TNF-b ökar också inflammatoriska svaret och kan inducera apoptos hos cellen. Dessa kommer att varna kringliggande celler att där är ett angrepp och få dem att producera protein som t.ex. bryter ner främmande DNA/RNA.
TNF-y (gamma) produceras för att aktivera NK-celler.
NOD -like receptors
Dessa är intracellulära proteiner som flyter runt i cytosolen och när de aktiveras, bildar en dimer och startar en kedja av reaktioner. Resultatet är att inflammatoriska mediatorer skapas och Inflammosome. Inflammosomen kommer göra att cellen går igenom Pyroptosis (Proinflammatorisk celldöd), självdöd genom att den tar hål på sitt eget membran. Detta är inte samma som apoptos, då när detta händer kommer cellen att frige alla sina mediatorer och kraftigt förstärka inflammationsreaktionen.
Aktiveringen av NOD-like receptors kan ske genom att K+ börjar strömma ut ur celler, innifrån eller att extracellulärt ATP aktiverar kanalerna. ssRNA/dsRNA/DNA och DAMP/PAMPs kan även aktivera det, genom att det blir löst i cytosolen och reagerar med receptorerna.
DAMP/PAMP kan dels komma in från bakterier och dels uppstå när Lysosomer spricker och det som är i blir löst i cytosolen.
Monocyter
Monocyter utvecklar sig beroende på signaler:
- INF-y får en dödande fenotyp (M1) som
- IL-10: Antiinflammation cytokin vilket get sårläkande fenotyp (för att städa upp infektionen)
- GM-CSF: Ger dendritisk fenotyp som propagerar en överföring till den specifika immuniteten. APC.
Oposin och antikroppar (Ig) bundet till patogen gör att de kan ätas upp mycket snabbare. Ju mer bundet, desto bättre.
Samarbete mellan medfödda och adaptiva immunförsvaret
Det medfödda immunförsvaret kan rensa upp men rensar sällan upp infektionen helt och leder inte till immunitet. Det adaptiva måste hjälpa till för att uppnå detta.
Viktiga är att det medfödda immunförsvaret, precis som adaptiva, är specifika. Skulle något av dem vara ospecifikt, skulle kroppens egna celler angripas. Medfödda har bara ett bredare spektrum den reagerar på och den "grund-sekvenser" som brukar finns hos patogener.
Makrofager - medfödda responsen
- Producerar cytokiner
- Presenterar antigen
Lymfocyter - adaptiva responsen
- Producerar antikroppar (aktiverar komplementsystem som i sin tur aktiverar makrofager)
- Cytokiner
Celler och aktivering
Makrofager
- Bildar även; IL-1, IL-4, IL-6, IL-12, TNF-a osv
- Akktiveras av: INF-y (från lymfocyter), Bakterietoxin, Fibronectin
- Migrerar pga: C5, CAM, PDGF, TGF-b, Kemokiner
Lymfocyter
- Bildar: INF-y (interferon gamma)
- Migrerar pga: VCaM (Vascular) och ICAM (intracellular)
Plasmaceller
Bildar: Immunoglobuliner (IgG, IgA, IgM)
Mastceller
- Innehåller: Histamin
- Har: IgE receptor
- Sjukdom: Parasiter, nässelfeber
Eosinofila leukocyter
- Innehåller: Major Basic Protein
- Har: IgE receptor
- Sjukdom: Parasiter, allergisk astma och hösnuva
Pattern Recognition Receptors
Dessa receptorer spelar en viktig roll i det medfödda immunförsvaret genom att detektera molekyler som tillhör patogener och på så sätt aktivera försvaret. Dessa kan även kallas för Primitive Pattern Recognition Receptors, eftersom det är ett gammalt system och utvecklades innan vårt adaptiva immunförsvar.
Receptorerna ser även till att antigen-specifikt immunförsvar initieras och att inflammatoriska cytokiner släpps ut. Det finns flera typer, t.ex.; Receptor Kinases, TLR (Toll-Like Receptors), CLR (C-Type Lecitin Receptors)
Det finns två klasser;
- Pathogen-associated molecular patterns (PAMPs) - Som kommer från patogener
- Damge-associated Molecular Petterns (DAMPs) - vilka då släpps ut vid cellskada eller död
Fagocyter
Fagocytos
Sker genom att cellen omringar bakterien via Endocytos och bildar en Phagosome. I cellen finns sedan även lysosomer, som innehåller ämnen som kan bryta ner bakterier. Dessa två slås ihop och bildar en Phagolysosome. Här dödas och bryts bakterien ner. MHC 2 (Major Histological Complex 2) tar bitar av det nerbrutna materialen (peptider) och visar upp som APC (antigen presenting cell). Överflödet avges till vävnaden igen.
Vissa bakterier har dock ytterliggare skydd och kan stå emot fagocyternas lysosoma aktivitet. Då kan T-hjälpar-celler frisätta ämnen som stimulerar makrofager att aktivera andra typer av enzymer och skapa en "Respiratory Burst", vilket frisätter fria radikaler m.m, vilket angriper patogenen.
För att fagocyten ska kunna bryta ner bakterierna måste den binda in till dess ytan, vilket görs genom att läsa av kolhydratstrukturen. Om bakteriern har en extern kapsel går inte detta. Då kan komplementsystemet och antikroppar istället märka upp ytan och underlätta fagocyternas arbete. Detta kalla Opsonisering.
Makrofagens funktioner
- Anti-mikrobiell funktion: Oxygen Radicals (ROS), NO
- Sår-städande: Fagocyteraroch bryter ner med enzymer (collagenase, elastase)
- Matris syntes och regulation
- Tillväxtfaktorer (TGF-b, EGF, PDFG)
- Cytokiner: TNF-a, IL-1, IFN-y
- Prostaglandiner: PGE2
- Cellrekrytering
- Tillväxtfaktorer: PDGF, TGF-b, EGF, IGF
- Cytokiner: TNF-a, IL-1, IL-6
- Fibronectin
- Angiogenesis (Bildande av kärl)
- Tillväxtfaktorer: bFGF, VEGF
- Cytokiner: TNF-a
Jätteceller är stora celler som består av att flera makrofager har gått samman för att bilda en stor cell.
Makrofagers roll och styrning
Dessa håller rent genom att äta upp materia. De bildar Growth Factors för att öka tillväväxt, vilket främjar Angiogenes (bilda nya kapillärer) och Remodeling (ombyggnad av ECM). De vildar även koagulationsfaktorer, prostaglandiner och NO.
Neutrofiler
Kan fungera som makrofager, men kan inte äta riktigt lika många bakterier innan den dör. Dessa är de vanligaste vita blodkropparna.
Neutrofilen har även defensiner som kan sticka hål på patogenernas membran. Är patogenen för stor för att ätas upp, kan de utsöndra toxiner.
NK-celler (Natural killers)
Är kroppens polis, som ständigt kontrollerar cellerna om de uttrycker sådan kod som de kroppsegna gör. Identifieras avvikelse så initierar de dödande av t.ex. patogen eller cancer. Inducerar apoptos i cellen.
Komplementsystemet
Det är bara när det medfödda inte klara av att ta hand om patogen (vilken den gör i 99% av fallen), då sparkar adaptiva igång efter ca 10 dagar. Komplementsystemet är en del av det medfödda men hjälper det adaptiva också.
C3 är ett protein till Komplementsystemet och det finns mycket i blodet, därför upptäcktes det tidigt att vi hade detta immunförsvar. Komplementproteiner bildas av främst levern men även gliaceller, makrofager i små mängder. Proteinerna cirkulerar som inaktiva. Komplementsystemet finns därför även i hjärnan och i ögat. Både då det kan passera BBB (Blod-Hjärn-barriären) och då gliaceller kan producerar det.
Multiresistenta bakterier har inte något extra skydd mot Komplementsystemet men bakterier har olika vägar att hindra detta.
De inaktiva formerna är generellt utan a/b, alltså C3 klyvs till de aktiva formerna C3a och C3b.
Dess huvudfunktioner är
- Rekrytera inflammatoriska celler (C3a/C5a)
- Oponisera patogener (C3b)
- Döda patogener med MAC-komplex(C5b-C9)
Aktiveringsvägar
Systemet kan aktivera genom tre vägar:
Klassiska - Antikroppar
Fungerar ihop med antikroppar som skickas ut av det adaptiva immunförsvaret, som binder in till patogen. När antigen har bundit in kan komplementfaktorer (C1) också binda in och aktiverar då komplementsytetmet. IgG och IgM krävs för att aktivera på cell, IgA duger inte och därför får man inte spontan aktivering hela tiden.
C1q, C1r, C1s binder till antikroppen och Aktiverar C4b/C2a (C3 konvertas)
Lektiner - Mikrober med Mannosgrupper
Använder Lectine, som är medfödda protein som känner igen specifika sockerarter. När de binder till socker på patogen, kan de sedan aktivera komplementsystemet, även här via C3. Är ofta Mannan-bindande lectin (MBL).
Lektinvägen aktiveras av Mannos, N-acetylglukosamin, Fukos, Acetylerade molekyler (fikoliner).
Varför inte vår egna Mannos angrips är då vi behandlar den och gör den extra negativ. Detta gör inte bakterier.
MBL (Manos Binding Lectin), Ficolin tilll Oligosakaraider
Både MBL och Ficolin binder till MASP-1 och 2 (Mannos-Associated Serine Protease)
Detta Aktiverar också C4b/C2a (C3 konvertas)
Alternativa vägen - Membranaktiverat, Bakterier, svamp, virus, tumör
Spontan hydrolys av C3 till C3H2O som aktivera systemet spontant.
Faktor B (fB) och Faktor D (fD) känner av C3H20 och Bb binder in och klyvs genom klassika C3 konvertas (från klassiska C3 konvertas) och amplifierar den alternativa vägen. Denna vägen aktiveras spontant i frånvaro av inhiberande molekyler hos mikrober (våra celler har inhiberare).
C3bBb bildar ett C3 konvertas, precis som i de andra vägarna.
Gemensamma vägen
C3 blir C3a: Alarmera och informera olika celler om att vi har en infektion. Mast-celler (Histamin) , Monocyter och Neutrofiler. Är en av de stora anledningarna till inflammation.
C3b som bildas tillsammans med C3a då C3 klyvs ger istället och sätter sig på patogen (Opsonering), vilket gör att Fagocyter lättare hittar och aktiverars till att äta upp dem.
C5 till C9 bildar Membranattack-komplex som (MAC) som gör hål på Gram-negativa membra. Positiva har för tjock för att den ska klara av det.
När många C3Bb sitter ihop nära kommer specificiteten att ändra och C5 börjar klyvas istället. Detta då C3-konvertas (C4b2a) går ihop med C3b och bilar C4b2a3b (C3/C5 konvertas) Detta ger MAC (membran attack complex) som fastnar i membranet. På fagocyterar har man sedan en CR (C-receptor) som känner av komplementfaktorer på ytan av bakterier.
Hos Gram-positiva bakterier är det Oposinering och Anafylatoxiner som är viktiga då MAC inte tar sig igenom Peptidoglycan, som är det yttre skall som skyddar. Hos Gram-Negativa kan även MAC aktivera och lysera bakterierna.
C5 aktiverar sedan flera olika system beroende på celltyper, det främjar bland annat inflammation och kemotaxi.
C3b främar fagoxytos då det binder till mikroberna och ger bättre fäste för fagocyter (Opsonisering). C3b kan även leda till upplösning då det hjälper MAC att binda in.
Kroppen har en hela familj av komplementhämmare så att kaskaden sker där det behövs och inte i hela kroppen. CD59 har alla celler i kroppen och därför lyseras de inte av MAC komplexen.
Ett sår som inte läker
Läkningsprocessen är uppdelat i 4 faser:
- Hemostas - Blodstillning
- Inflammation
- Proliferation
- Remodelling
Klassiska symtomerna för inflammation
- Rodnad
- Värme
- Svullnad
- Smärta
- Nedsatt funktion (inte alltid)
Hemostas, Blodstillning - Tidig fas
- Trobocytaggregering
- Koagulationskaskad
- Koagel - Trombin klyver Fibronogen -> Fibrin
- Vasokonstriktion
- Sker inom 5-10 min och medieras av:
- Prostaglandiner,
- Serotonin
- Thromboxane
Inflammation - Upp till dag 6 - Tidig fas
När vävnad blir skadad eller kommer i kontakt med patogener (t.ex. via deras TLR) kommer de att utsöndra mediatorer som framkallar inflammation och tillkallar immunförsvar. Detta sker inom 20 minuter och inkluderar ämnen som.
- Histamin (Mast-celler och basofiler)
- Kinins (bradykinin m.f)
- Prostaglandiner
- Leukotriener, aktiverar benmärgen att produera mer immunceller.
- Komplementfaktorer
Akut inflammation är ofta det första svaret som sker när man får en skada på huden/slemhinna och ger det medfödda immunförsvaret en möjlighet att hantera.
Kärldilatation / Vasodilatation och ökad kärlpermabilitet
Utsöndringen av mediatorer kommer påverka endotel och kärl, vilket ger en vidgning. Mer blod kan komma till platsen. Detta orsakas av Prostacyklin och NO (av eNOS som bildas av endotelcellers NO syntetas). Viktigt även för att proteiner som komplementfaktorer ska kunna nå platsen.
Detta leder till två av symptomen för inflammation; Rodnad och värme, som orskas av ökad blodmängd i vävnad. Smärta kan även uppkomma då det kan trycka mot nerver.
Mer blod (immunförsvar) till platsen och Neutrofila granulocyter vandrar ut till vävnad då luckor börjar öppnas (ökad kärlpermabilitet) mellan endotelceller, men även pga nekros av endotelceller. Denna vidgning orsakas av: Histamin, Bradykinin, PAF, Ca3a, Ca5a, Leukotriener.
Mobilisering av fagocyter
Flera av kemikalierna som frisläpps kommer att orsaka kemotaxi (Histamin, Kinins, Prostaglandiner), vilket är den markör som lockar in immunceller till att migrera till vävnad.
Dessa molekyler gör att endotelet uttrycker Selektiner (adhension), och drar med sig in immunceller. Neutrofilerna är de första och direkta, medan makrofager och monocyter (även eosinofiler) kan komma 5-6h senare som svar på mediatorer från Neutrofilerna.
Migrationen över epitelet sker enligt följande 4 steg och följs sedan av Kemotaxi till rätt plats i ECM.
Rolling
Fagocyter binder med sina Adhensionsmolekyler till epitelens E-Selektiner, vilket ger en lösare kontakt mellan fagocyt och kärlvägg. Då det är svagt, kommer fagocyterna att börja rulla mot kärlväggen, då bindningen inte är stark nog för att hålla.
Activation
Kemokiner (som IL-8), komplementsystemet 5Ca och N-formyl peptider från bakterier binder till receptorer på fagocyternas yta, vilket ger en G-protein medierad aktivering. Detta gör att deras Integrin-molekyl ökar sin affinitet för Ig-Superfamily adhesion på endotelet. (CAM = Cellular Adhesion Molecule)
Arrest and Adhesion
Nu kan Ig-Superfamily från fagocyterna binda till IgCAMs på endotelet och skapa en stark bindning som kan börja föra fagocyten till EMC.
Transendothelia migration
Fagocyten kan rulla ut från kärlet och till vävnaden där den behövs.
Kemotaxi
När väl cellerna tagit sig ut till vävnaden, kommer högre koncentration av kemikalierna fungera som vägvisare. De kommer att vandra mot den högre koncentrationen av Ca5a och Cytokiner (Kemokiner).
Proliferation - Dag 4 till 14 - Mellan/Sen - fas
- Angiogenes : Bildande av kärl genom mediatorer från inflammationen. (VEGF faktor)
- Granulationsvävnad: Fibroblaster producera nytt ECM (collagen,elastin, glycoprotein, fibronektin och hyaluronan)
- Epitelialisering: Keratinocyter nybildas och migrera till såret, sker då avsaknad av NO ger kontraktion.
- Kontraktion
Remodellering:
- Ombyggnad för att byta ut den temporära pluggen till en permanent matrix genom enzymer och nyproduktion av Kollagen typ 3, elastin och proteoglykaner
Ohämmad produktion av mediatorer ett problem
Om kroppen producerar ohämmad mängd mediatorer kommer kroppen att ta skada, vilket kan gestalta sig enligt nedan:
- Hög feber
- Hypotension
- Tachykardi, Dyspne
- DIC (Disseminerad intravasal koagulation)
- Hjärnödem
- Fatal chock
Endotelcellens roll
Endotelceller uttrycker många viktga delar som hjälper vid inflammation och läkning;
- Gaps öppnas: Permabilitet, ödem
- Selektiner: Leukocyt-migration
- Von Willebrand faktor: Trombocyt-pluggen
- Trombomodulin och Protein S: Antikoagulationen
- Fibrinolysaktivator: Fibrinolys
Terminering av akuta inflammationen
- Inflammationen kommer att pågå tills att skadeområdet är upprensat.
- De flesta mediatorer har kort livstid och degraderas väldigt snabbt, nästan omedelbart.
- Anti-inflammatoriska cytokiner (TGF-b och IL-10) hämmar produktion av Pro-inflammatoriska cytokiner (TNF, IL-12)
- Arachidonic Acid metabolism generera anti-inflammatoriska mediatorer (Lipoxin, Resolvin, Cox-2, PGE2)
Steril inflammation
En steril inflammation (aseptisk) är en som inte involverar mikroorganismer. Kan t.ex. bero på överbelastning eller vävnadsskador utan att patogener har tagit sig in. Aktiverar då t.ex. DAMPs, då de nekrotiska cellerna släpper ut molekyler som normalt inte ska finnas löst. Immunförsvaret reagerar på detta och bryter ner, samt skickar ut inflammatoriska cytokiner.
- Vävnadsspecifika fagocyter
- Rekryterade celler
- Neutrofiler och Mastceller
- Monocyter
- 2-3 dagar Makrofagar
- 5-7 dagar - få inlammatoriska celler.
Akuta fasreaktanter
CRP - C Reactive Protein
Från komplementsystemet
SAA - Serum Amyloid A
Produceras av levern och ges i svar på inflammation. Används för transport av kolesterol till lver och rekrytering av immunceller till inflammerade stället.
Fibrinogen
Ger myntrullebildning och ett högt SR (Sänkreaktion), bildas vid sårskada för koagulation.
Sårläkning
Primär sårläkning - Sårkanter i kontakt med varandra
Här bildar koagel en krusta och ett nytt epitel kommer till på ytan, starkt efter 3 månader.
Sekundär sårläkning - Sårkanter långt ifrån varandra
Här får såret läka öppet, vilket tar lång tid och fyller ut långsamt. Myofibroblaster försöker kontrahera såret men kommer läka ut som ett fult ärr.
Överdrivet fult ärr i huden kallas Keloid.
Försvårad sårläkning
Sårläkningen försvåras av dålig nutrition, cirkulation och syresättning. Man vill undvika infektioner, främmande kroppar, kortison, strålbehandling och hög ålder.
Bakterier och klassificering
Man kan ha en inflammation utan bakterier/virus (vävnadsskada, steril), men kan däremot inte ha en infektion utan bakterier eller virus. De är runt 1-3 um långa (patologiska bakterier) och är av formerna:
- Växer i närvaro av O2? = Aerob
- Gram-färgning röd = Gram-negativ
- Utseende = Stav (Bacillus), Rund (Kocker), Spiralvridna, Pleoforma
- Miljö: Vilken miljö de föredrar; Temperatur, pH, vatten och syre.
Feber
Inflammation är ett lokalt svar medan feber blir ett systemiskt, med förhöjd kroppstemperatur. Vid akut inflammation skapas IL-1, IL-6 och TNF-a, vilka ger en systemisk effekt och påverkar Hypothalamus att producera Prostaglandiner, som ger feber.
Förutom feber så bidrar dessa ämnen till mer akutfasproteiner (CRP syns här) och ökad produktion av vita blodkroppra (Leukocytosis) i benmärg.
Febern i sig ökar frisättning av järn och zink från mjälte och benmärg, vilket gör de mindre benägna att ge stöd åt bakteriell tillväxt. Feber ökar även reparationsprocesser och metabolism.
Sårläkning
Primär sårläkning - Sårkanter i kontakt med varandra
Här bildar koagel en krusta och ett nytt epitel kommer till på ytan, starkt efter 3 månader.
Sekundär sårläkning - Sårkanter långt ifrån varandra
Här får såret läka öppet, vilket tar lång tid och fyller ut långsamt. Myofibroblaster försöker kontrahera såret men kommer läka ut som ett fult ärr.
Överdrivet fult ärr i huden kallas Keloid.
Försvårad sårläkning
Sårläkningen försvåras av dålig nutrition, cirkulation och syresättning. Man vill undvika infektioner, främmande kroppar, kortison, strålbehandling och hög ålder.
Bakterier och klassificering
Man kan ha en inflammation utan bakterier/virus (vävnadsskada, steril), men kan däremot inte ha en infektion utan bakterier eller virus. De är runt 1-3 um långa (patologiska bakterier) och är av formerna:
- Växer i närvaro av O2? = Aerob
- Gram-färgning röd = Gram-negativ
- Utseende = Stav (Bacillus), Rund (Kocker), Spiralvridna, Pleoforma
- Miljö: Vilken miljö de föredrar; Temperatur, pH, vatten och syre.
Kapel: Slime-lager för att undvika fagocytos och fästa på väggar
Flagella: Svans för att förbättra rörelse hos bakterie
Pili/Fimbria: Utskott på bakterien som gör att de kan binda mot celler. Skillnaden mellan de båda är längden. Används också för att utföra Konjugering, där bakterier byter gener.
Mycobakterier: Svagt grampositiva och orsakar tuberkulos.
Mycoplasma: Saknar cellvägg, är inte grampositiva eller negativa då de bara har ett membran.
Dessa delas sedan främst in i två medicinska intressant kategorier
Grupp 1
Gram-positiva/negativa kocker/stavar
Grampositiva kocker har "coccus" (Streptococcus, Enterococcus, Staphylococcus)
Grampositiva stavar: Basillus, Clostridum, Cornyebacterium, Listeria
Gramnegativa kocker: Nisseria, Moraxella
Gramnegativa spiralvridna: Spirocheter
Gram-negativa har Lipid-A på sitt yttre cellmembran och det är toxiskt.
Grupp 2
Bakterier som inte kan passa in i grupp 1.
|
|
Gram-positiva
|
Gram-Negativa
|
|
Membran
|
Två lager
- Inre cytoplasmatiskt membran
- Yttre tjockt peptidoglykanlager
|
Tre lager
- Inre cytoplasmatiskt membran
- Tunt peptidoglykanlager
- Yttre membran med LPS
|
|
Lipidinnehåll
|
Lågt
|
Högt
|
|
Endotoxin
|
Nej
|
Ja
|
|
Periplastiskt rum
|
Nej
|
Ja
|
|
Porinkanaler
|
Nej
|
Ja
|
|
Känsliga mot Pencilliner
och Lysozymer
|
Ja
|
Nej
|
Bakteriers delning - binär fission
Bakterier är encelliga organismer (prokaryoter) och inte som människa, där flera celler arbetar ihop. Detta gör att deras tillväxt inte utgörs av att växa i storlek, utan att göra det i antal. Detta görs genom Binär Fission. Tiden en celldelning tar, generationstiden, kan vara så kort som 20 minuter.
Bakterien duplicerar sitt DNA innan den delar sig och detta måste vara väldigt exakt, då ett fel av DNA-polymeras ger felaktigt baspar och gener. Avskiljning sker genom att DNA-kopiorna separeras och sedan skiljeväggen delas och två bakterier har bildas. Bakterien är haploida och kromosomen innehåller därför en kopia av varje gen.
Förutom den DNA-kromosom som bakterien har, så kan även en extra DNA-del (Plasmid eller Bakteriofager) finnas.
Bakterier kräver olika miljöer, och det varierar på faktorer som; temperatur, pH, vatten, syre och näring.
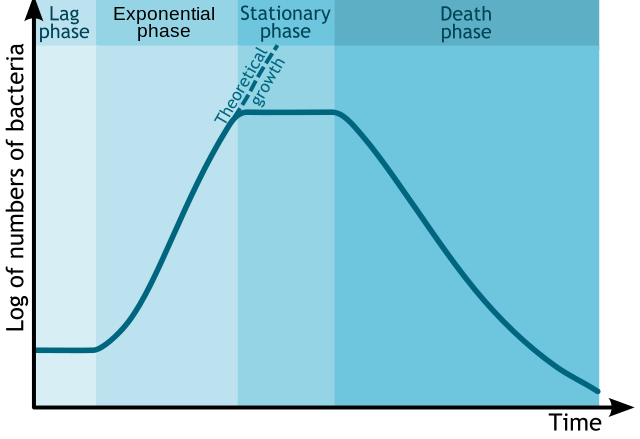
Delningen görs i flera faser;
Lag: Där bakterierna anpassar sig till miljön
Log: Där de delar sig i stabil hög takt (log då det är en exponentiell tillväxt) 1 => 2 => 4 => 8…
Stationär: Tillväxten slutar, lika många dör som tillkommer, brist på näring, ökat avfall eller platsbrist.
Avtagande/död: Näringen har tagit slut och bakterierna avdör.
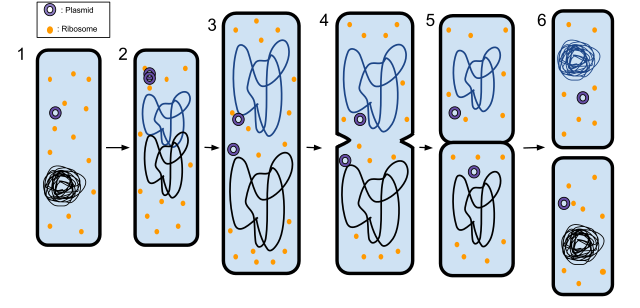
Plasmider
Är en obereonde cirkulär och dubbelsträngad DNA-enhet som är självreplikerande. Dessa kan finnas i flera kopior, men antalet varierar beroende på bakterietyp. Dessa kan bära gener för antibiotikaresistens och virulensgener för toxiner.
Dessa finns oftast i flera uppsättningar (10 till 100) i samma bakterie och obereonde av kromosomen. Konjugerande Plasmider som bär antibiotikaresistensen är stort problem eftersom de förs mellan bakterier i hög frekvens. Många plasmider har IS-sekvenser (insertion) vilket medför att de enkelt kan integreras med andra plasmider eller kromosom.
Bakteriofager
Är bakterievirus som överlever både i och utanför bakterien. Reproduktion av denna leder normalt till bakteriens död, vilket inte Plasmiden gör. Består av ett hölje (kapsid) av protein som omger nukleinsyra.
Virulenta/Lytiska bakteriofager: Molekylärt myteri
Temperata bakteriofager: Ger valmöjlighet
Näring och energi
Bakterier är heterotrofa och tar därför sin näring från organiska ämnen. Bryter ner molekyler som kolhydrater, lipider och proteiner. Aminosyror, oligosakarider och små peptider tas upp genom dess cellvägg för att bilda ATP. I membranet har bakterierna Poriner som tillåter transport .
Aeroba (använder syre) använder O2 som fungerar som elektronaccetpr vid omvandling av näring till energi. Detta ger en bättre utvinning av ATP per mängd näring.
Anaeroba behöver inte O2 utan har Nitrat, sulfat och karbonat som elektronacceptorer och har därför en mycket lägre utnyttjande av näring till energi.
Fermentation är det som sker när det saknas syre och ger ungefär 1/10 av den energi som skulle kunna utvinnas om syre (O2) var tillgängligt. Det som sker är att energirika organiska molekyler bryts ner till mindre energirika molekyler.
- Obilgata aerober, liknar människan kedja med glykolys, citronsyracykel och elektrontransportkedja.
- Fakulativa aerober: Använder syre som elektronaceptor, men kan även växa genom fermentering, alltså utan syre. Bättre med syre.
- Aeurotloreant Anaerobs: Växer lika bra med och utan syre
- Obligata anaerober: Vill inte ha syre, dör annars
- Microaerophila bakterier: Använder fermetering och klarar därför låga syrenivåer
Generationscykel
Bakterier försöka sig snabbt och har en generationscykel på ungefär 20 minuter. De kommer att försöka sig så länge det finns näring, vilket leder till ett snabbt tillskott av bakterier, som sedan (vid näringsbrist) dör av och bildar toxiska biprodukter.
Gram-infärgning
Infärning för Gram positiv/negativ görs för att avgöra cellvägg och membran för bakterierna. Det är tjockleken av Peptidoglykan som blir avgörande för om färgen består, som är en tjock cellvägg utanför cellmembranet hos Gram-positiva.
På de gram-negativa finns istället ett yttre membran och ett intre cellmembran med ett Periplasmatiskt rum mellan där Lipoprotein och Peptidoglykan finns.
Mutation och rekombination
De korta cyklarna hjälper även bakterier att muteras oftare och bidra till nya sjukdomar och antibiotika resistens. En förändring i genomet kan därför ske genom två sätt, Mutation och Rekombination. Sedan kan gener förflytta sig till andra bakterier genom Genöverföring.
Mutation
Spontan förändring i DNA som uppkommer vid delning, kan bero på yttre påverkan (miljö och kemikalier kan vara mutagena). Det är inte vanligt, men bakterier har många celldelningar och därför ger det utrymme för många mutationer.
Rekombination
Via Transposition som innebär att DNA sekvens flyttar till annan del (Juping genes) och ger en ny kombination som kan ge t.ex. nya ytantigener. Detta kan ge stor förändringar i genetiska materialet .
Det kan även ske förflyttning av Transposoner (större element av gener) från kromosom till plasmid (t.ex. antibiotikaresistens).
Horisontell Genöverföring
Bakterier kan föra över gener från en typ av bakterier till en annan, därför kan t.ex. antibiotikaresistens spridas. Detta sker genom att överfört DNA rekombineras sig med genom i mottagarcell eller att Plasmid som kan replikera sig i mottagarcell. Genöverföringen kan ske på flera sätt;
Transformation
Upptag av fritt DNA som läckt ut från andra bakterier, kan vara DNA fragment eller plasmider. Vanligt förekommande.
Transduktion
DNA-överföring med hjälp av bakteriofag(virus) (RNA/DNA) som byter bakterie. Integrerar sig sedan med befintlig DNA eller degraderas. Relativt vanligt förekommande. Bakteriofager angriper bara bakterier.
När en bakteriofag angriper en bakterie slår den ihop sitt DNA med bakteriens och börjar sedan prodcuera kopior av sig själv. När dessa kopior skapas kan klyvning av DNA ske på platser som gör att befintlig DNA tas med (t.ex. antibiotikaresistens). Detta packas då i de nya bakteriofagerna, som sedan infekterar nya bakterier och för gener vidare.
Konjugation
Aktiv överföring av DNA från givar till mottagar-cell. Vanligt hos gramnegativa bakterier (promiskuösa), har stor klinisk relevans och involverar antibiotikaresistens och toxingener. Oftast är det Plasmid eller fragment av en som byter ägare genom Sex-Pilus som kopplar ihop bakterierna som en brygga.
Är beroende av Tra-gener på konjugativa plasmider som kodar för bl.a sex pili. Då även dessa tra-gener kan överföras kommer en mottagarcell kunna omvandlas till en givarcell och snabbt föra vidare. Antibiotikaresistens överförs ofta. Givarcellen producerar vidhäftningsfaktorer som fäster till mottagarcellen och stimuleras av mottagercellen producerar fermonliknande faktor.
Patogenetiska mekanismer och virulensfaktorer
Virulensfaktorer definieras som cellbundna (assoiceras med bakteriens cellvägg) och Lösliga (utsöndras och produceras av bakterien). Båda delar bidrar till bakteriens virulens (sjukdomsalstrande förmåga).
Kolonisation: Bestående normalflora av mikrob på ett ställe där den inte orsakar sjukdom.
Asymptomatiska bärare/infektion
En person som utan symtom varit infekterad längre tid.
Virulens / Patogenecitet
Mikrobs förmåga att orsaka sjukdom.
Virulensfaktor
Product eller strategi som bidrar till virulens, kolonisera, invadera och orsaka skada. Kan vara: Exotoxin, Endotoxin och cellväggskomonenter.
Flageller: För att öka rörelse och ibland vidhäftning.
Slem/Kapsel: Är vanlig polysackarider som skyddar mott värdens inflammatoriska svar och komplementfaktorer. Kan ge vidhäftning och ett system för att undvika immunsystemet, vilket gör att bakterien kan penetrera.
Sporbildning: Genom att bilda en spor runt sitt DNA och skickar ut det, kan bakteriens genom överleva extrema förhållanden tills att den ligger i gynsam miljö och kan börja leva igen.
Adherens - Adhesiner
Kopplande av bakterie mot yta, som slemhinna eller cell kan ske på olika sätt;
- Pili/Fimbrier: Vidhäftning till slemhinnor
- Adhesin: Skapa tät kontakt med värdcell
- Biofilmbildning: Binda ihop mot yter och varandra för att bilda flera lager bakterier
Invasion
- Invasiner: Tvinga icke-fagocytiska celler till upptag
- Omdirigering av aktin i värdcell: Hjälper bakterier att röra sig inom och mellan värdceller
- Inbindning till och inträde i M celler: M-celler nyttjas som transport till underliggande vävnad.
Kolonisation och överlevnad
- Rörlighet och kemotaxi: Nå slemhinner , som tunntarm och urinblåsa med starkt flöde
- Sekretoriskt IgA proteas: Hindra att bakterie fångas i Mucin
Järn
- Sideroforer: Förser bakterie med järn genom binda till transferrin, Hb osv
- Järnavhållsamhet: Järnkrävande enzym ersatta med mangan istället
- Toxin: Dödar värdcell och förser bakterier med järn
Skydd mot immunförsvaret
- Kapsel: Förhindra fagocytos; minskar komplementaktivering
- Förlängning av LPS O-antigen: MAC bildas ej, serumresistens
- C5a peptidas: Stör komplementsignal
- Toxiska proteiner: Dödar celler som t.ex. fagocyter
- Variera ytantigener: Undviker därför antikroppssvar
- Hämmta fusion mellan fagosom och lysosom: Genom att hindra detta kan bakterierna överleva i fagocyterna.
Cellbundna
Peptidoglykan, Teichon-, Lipoteichonsyra: Gram-positiva bakterier
Lopopolysackarid (LPS = Endotoxin): Gram-negativa bakterier
Dessa bidrar till Pyrogener; akutfas-reaktion med inflammation och feber.
Andra virulensmekanismer
Bakterier kan vara intracellulärt växande och då gömmer de sig för immunsystemet och antibiotika penetrerar inte. De kan även ha mutationer som gör att de får resistens, som mot antibiotika.
Toxiner, Endotoxin och Exotoxin
|
Endotoxiner
Gram -negativa
|
Exotoxiner
Gram negativ och Positiva
|
- Del av cellvägg
- LPS
- Värmestabilt
- Toxoider kan inte producera
(= inativerat toxin)
|
- Lösgörs från bakterie
- Protein
- Värmekänsligt (oftast)
- Toxoider kan produceras
|
Exotoxiner
Giftiga proteiner
Neurotoxiner: Angriper nevsystem (Botulinomtoxin)
Enterotoxin: Angriper Gi-kanalen genom hindra NaCl-reabsorbation, ökar NaCl-sekretion eller döda epitelet. Orskar därför diarre.
- Infektiös diarre: Infekterar GI och löpande frisätter Exotoxin
- Matförgiftning: Växer och frisätter exotoxiner i maten men infekterar inte tarmen.
Pyrogena Exotoxiner: Stimulera frisättning av cytokiner, vilket ger systemiskt svar som Feber
Vävnadsinvasiva Exotoxiner: Gör att bakterierna kan skada vävnaden. Dessa har enzymer som kan bryta ner kollagen, fibrin, DNA och blodkroppar.'
Superantigener
Är toxiner som gör polyklonal aktivering av T-celler genom att korsbinda MHC-2 molekyler på APC-celler med T-cells receptor. Detta leder till stora mängde proinflamatoriska cytokiner och kan ge systemisk inflammation och sepsissyndrom.
Endotoxiner
Kan vara Lipid A, som finns hos en del gramnegativa bakteriers yttermembran, LPS (Lipopolysackarid). Detta utsöndras inte, utan avges när bakteriens membran tar skada, som bryts ner eller dör. Detta innebär att antibiotikabehandling av personer med dessa bakterier kan förvärra tillstånd då bakterien lyserar.
Cytotoxiner
Grupp toxiner som inte hör hemma i andra grupper och som hämmar proteinsyntes i eularyota celler. Exempel är Difteritoxin, Pertussistoxin (kikhosta).
Etablering av infektionssjukdom
- Sammanträffande: Agens möter värden
- Inträde: Agens kommer in i värden. Kan ske genom Penetration (sår, skador, bett) eller Tillträde av håligheter, som luftvägar, urinvägar eller mag/tarmkanal.
- Spridning: Agens sprids vidare från ingångsstället
- Förökning: Agens multiplicerar sig i värden. Inkubationstid är den tid det tar för mikroben att övervinna värdens försvar och tillväxt till mängd som orsakar symptom.
- Skada: Agens eller värdens försvar, eller båda, orsakar vävnadsskada. Skadan kan sedan ske på flera sätt
- Ren mekanisk: Spolmaskinfestation
- Celldöd
- Förändring i värdens metabolism
- Skada pga värdens egna immunförsvar
- Utgång: Agens eller värden vinner, alternativt samexisterar.
Man kan även se det som:
- Adhesion; Fästa vid slemhinna/hud
- Kolonisering; tillväxt
- Invasion; blodbana
Quorum sensing
Interbakteriell kommunikation som tillåter att de pratar med varandra genom "autoinducers" (bakteriernas signalsubstanser). Kan på så sätt reglera genuttryck och därför tillväxt.
Hämma tillväxten
Kinoloner
Inhiberar uppnystning (Topoisomeras) av DNA genom hämam DNA-gyras under DNA-replikation leder till att bakterierna dör.
Cellväggsstörande
Ämnen som hindrar cellväggssyntesen, som penicillinet.
Bakteriers smittvägar
- Inhalation (droppsmitta)
- Faekal
- Blod (nålstick)
- Trauma
- Sexuell (STI), t.ex. Chlamydia
- Insektsburen (vektorburen), t.ex. borelia
Smittdosen har stor betydelse för om man blir smittad, där vissa sorter kräver 200 bakterier (Shigella dysenteriae) och andra miljoner till miljarder (Salmonella enteritidis).
Bakterieavdödning
Sterilisering
Sker genom autoklavering, joniserad strålning och filter. Leder till total död av bakterier, virus, svamp och sporer
Desinfektion
Sporer, virus och mycobakterier kan överleva.
Antiseptisk agens
Etanol, isopropanol, jod och klorhexidin. Dödar bakterier på hudytan. Etanol är 70% då det ger bättre aktivitet i närvaro av vatten.
Normalfloran av bakterier
Om normalfloran orsakar infektion är det opportunist.
Strikta patogener är sådana bakterier som ej kan förekomma som normalflora, dvs orsakar infektion i så fall.
Hudens normalflora innehålelr Stafylokocker, Stahylococcus aureus, Streptokocker, Candid albicans (jästsvamp) och Propionbacterium acnes.
Tarmens normalflora innehåller Bacteroides fragilis, Enterococus spp, jästsvampar, Enterobacteriacae och E-coli.
Septisk Shock
Det delas upp i olika stadier där det går från milt till allvarligt och man vill därför hindra det så snabbt som möjligt.
SIRS -> Sepsis -> Septiskt Shock -> MODS
Patogener i blodet gör att vita blodceller upptäcker det och ger adekvat respons, som att rekrytera andra vita blodceller och vidga kärlen. Detta då immunförsvaret normalt upptäcker patogener utanför kärlen och lokalt. Detta sker nu systemiskt.
Vidgade kärl med mycket permabilitet och läckande vätska får problem att transportera ut syre till vävnaden.
- Rekrytering av vita blodceller
- Ökar diametern på kärlen och permeabiliteten hos kärlen => Blodtryck sjunker
- Skador hos blodkärlen som kommer öka koagulationen
SIRS - Systemic Inflammatory Response Syndrome
Detta behöver inte betyda att där är en septisk shock, bara att vi har en systemisk påverkan. För att ha detta måste man uppfylla 2 av 4 kriterier nedan (SIRS kriteria)
- Kroppstemperatur (över 38C eller under 36C).
- Hjärtfrekvens på över 90 slag/min
- Hög Andningsfrekvens (RR) > 20 eller PaCO2 < 32
- Vita blodceller, > 12,000 eller < 4,000 eller > 10% band cells (omogna vita blodceller)
Sepsis
Uppfyller SIRS och har en bekräftad infektion
Septisk shock
Sepsis + lågt blodtryck
MODS - Multiple Organ dysfunction syndrome
Har septisk shock med organsvikt. Sviktar levern kommer den inte kunna producera immun-proteiner och inte kunnat rena kroppen.
Behandling
Bredspektrum antibiotika ges för att behandla problemen snabbt och om det inte fungera kan man ge mer specifik behandling. Man behöver även få upp blodtrycket, vilket sker med intravenös vätska och Pressors (pressar ihop kärlen). Viktiga är att ta ut blod för att odla innan man ger antibiotika, annars stör man labbproverna.
CRP och ESR kan mätas för att se hur behandlingen går då det är markörer för inflammation. Laktat ska även mätas före och efter.
Antibiotika
Antibiotika kan angripa bakterier på flera sätt, enligt nedan.
Cellvägg
Andra antibiotika kan angripa syntesen av cellväggen och därför hindra att bakterien kan skydda sig och dör.
Mänsliga celler har inte cellvägg (Peptidoglykan) och tar därför inte skada av det.
Cellmembranet
Antibiotikan kan binda till cellmembranet och ändra strukturen hos det, vilket gör att cellulära molekyler läcker, tar in vätska och går sönder. Cellmembranet är innanför cellväggen (Peptidoglykan).
DNA/RNA syntes
En klass av antibiotika hindrar bakteriens DNA eller RNA syntes.
Proteinsyntes (Ribosomer)
Eftersom proteinsyntes görs av ribosomer via RNA, angriper man en av subenheterna på Ribosomerna och hindrar transkriptionen. Detta gör att batkerien kan leva, men inte kan skapa några brukbara proteiner och hindrar alltså tillväxt.
Går in som metaboliter (Folsyrametabolismen)
Dessa hindrar folsyrametabolismen genom att hindra PABA (Para-AminoBenzoic Acid) att bli metaboliserad till folsyra, som är en av delarna till DNA. Därför kan inte DNA inte sytetiseras. Människor syntetiserar inte Folsyra och därför påverkas vi inte.
Antibiotikaresistans hos bakterier
Antimikrobiella proteiner
Komplementsystemet
Förklarades tidigare.
Interferoner
Anti-mikrobiella peptider är som en alternativ behandling för antibiotika. Är små peptider som reagerar starkt med fosfolipider och bilder porer i membran. Man försöker hitta alternativ från människa, djur och växter som kan hjälpa att döda bakterier.
Normalt i kroppen svarar infekterade celler genom att utsöndra Interferonet då de blir infekterade. Detta bidrar då till en ökad tillverkning av produktion av protein som blockerar proteinsyntes och stör. RNA endonukleas som bryter ner viral RNA och eIF2 som startar en antiviral protein syntes. Främst INF-a och INF-b får denna effekt.
INF-y: Aktiverar NK-celler och makrofager för att angripa cancerceller.
E-coli
Kan med sina fimbrier utföra Adhesion och klättra i urinvägsepitel då de binder till speciella di-D-galaktosid som finns på celler i övre urinvägar. Bindningen specificitet bestämmer därför var de kan klättra (organotropism).
Denna förmåga att binda sig kvar finns även i vår normalflora, annars skulle bakterierna sköljas bort från våra slemhinnor.
Exotoxin: De har Hemolysin (HlyA) vilket lyserar Erytrhocyter. Detta syns ofta hos stammar som ger UVI. Ger inflammation av i slemhinna cytokin/chemokin produktion och rekryterar Leukocyter. Detta sker genom Sekretionssystem där bakterien "injicerar" proteiner i den Eukaryota cellen.
Kapsel: Bakterien kan skydda sig med en kapsel och fasvariation, den kan alltså stänga av och sätta på kapsel.
Endotoxin: Toxinet som sitter på utsidan och är LPS (Lipopolysackarid), alltså Gram-negativ då detta sitter i membranet och inte det tjocka Peptidoglycan-området hos gram-positiva.
UVI Urinvägsinflammation - Utredning och behandling
Man har de klassiska symtomen som Trägningar, sveda vid miktion och illaluktande urin, Cystit (Nedre Urinvägsinfektion).
Har man även ont i höger flank när man slår lite nätt, så är man "dunköm" och har Polynefrit, alltså övre urinvägsinfektion.
Det är över 80% av fallen som orsakas av E.Coli, men några procent kan orsakas av andra typer.
Urin - test
Nitrat går över till nitrit om man har mycket bakterier i urin. Man kan ha urinvägsinfektion utan att det syns på test, då det tar tid för bakterier att orsaka detta och det krävs en viss mängd.
Blod i urinet (3+ på test) kan bero på njursten eller mens, vilket gör att man då måste fråga, behöver inte vara pga Urinvägsinfektionen.
Man måste ha nitratkälla för att det ska ske (grönsaker). Så saknar man detta näringsintag kan man inte bli positiv på testet.
Serum
CRP kraftigt ökat (C-reaktivt protein) och därför en infektion
Blod
Leukocytos (förhöjda vita) innebär att man har infektion.
Blododling
Man tar olika rör för anaerob och aerob blodning, och man ser färgen i röret ändrar sig om det växer bakterier. I vårt fall var det E-coli
Resistansbestämning
Man tar en petriskål och sätter olika antibiotika på olika punkter i denna. Man ser sedan var bakterier har lyckats växa och var de dör ut. Detta ger oss en karta över vilka antibiotika som just denna bakterier är resistent mot och vad de dör av. Detta kallas Disk Diffusion Test.
Det man testar är de olika grupperna och perorala för att vara sådana man kan ta via tabletter.
- Ampicillin
- Cefadroxil
- Mecillinam
- Trimetoprim
- Nitrofurantoin
- Kinoloner
Kommer man in akut hinner inga odlingar göras och man får gå efter Empirisk behandling, symptomen och tidigare erfarenhet bestämmer antibiotikan. En kur klarar njurarna alltid av, det är vid andra dosen man får vara försiktig.
Etest Epsilometer test
Man har en gradient i Petriskål där antibiotika är mer till mindre resistans. Man bestämmer då avståndet/koncentrationen för var bakterier slutar växa/dör. MIC test, MIC-90 är mängden för där 90% dör.
Antibiotikabehandling
Man använder vårdguiden för att se vilket antibiotika som rekommenderas för UVI för just det landsting man jobbar i. Man har sedan en växling som görs, dels mellan patienter men även den aktuella. Man skriver alltså ut olika antibiotika till olika personer (varierar), men även olika till den drabbade. Detta för att undvika resistens hos individen men även hos populationen
Dosering och antal doser
Beroende på hur snabbt kroppen gör sig av med den specifika antibiotikan, behöver man ge olika mängder och olika antal doser. Det handlar om farmakokinetik, halveringstider osv.
Akutfasreaktanterna
CRP - Binder LPS och aktiverar komplementsystemet, viktigt att det stiger då det krävs för att avdöda bakterier.
LBP - Komplex med LPS, transporterar LPS till TLR4/CD14
A1-Antitrypsin - Proteashämmare
C3 - Komplement
I följd kommer plasmanivåerna att öka enligt:
LPS -> TNF -> IL1 -> IL-6/IL-8
Dessa går i vågor och CRP ökar först efter flera timmar, där finns alltså ett fönster där vi inte kan mäta något.
Har vi en lokal inflammation med låga nivåer får vi Makrofag-aktivering, Endotel-aktivering (migration av immunceller) och Komplementaktiver (C3a, C5a).
Vid systemeffekter, som fås vid moderata niveår, kommer hjärnan reager med fever, lever med akut-fas-reaktanterna (proteiner) och Benmärgen med att öka Leukocyterna.
Får man höga nivåer når vi istället för mot Septiskt chock.
Det adaptiva immunförsvaret har i experimentella modeller visat att de ej har något större betydelse för det akuta skedet (B och T -celler). Patienter som har IgA brist har inte högre frekvens av UVI. Det medfödda försvaret är alltså det viktigaste här!