Fallet
Person uppvuxen i Tanzani flyttat till Sverige och haft påvisad HIV sedan 7 år tillbaka. Nu utbredd svampinfektion och feber med nattsvettningar och viktnedgång. Hostar numera upp gulgröna blodblandade satser.
Man finner i mikrobiologisk undersökning syrafasta stavar och patienten behandlas med 4 sorters antibiotika. Där visas även sänkt CD4+ celler och efter antibiotika behandlas med antivirala medel mot HIV. En månad senare är värdena uppe mot normala igen.
Studiemål
HIV/AIDS
- HIV-1, HIV-2, HTLV
- Replikationscykel
- Patogenes
- Virulensfaktorer
- Diagnos
- Behandling (Varför fungerar det inte?)
- Resistensutveckling och Vaccin
- Epidemiologi
- Varför är HIV ett världsproblem
- Ursprung
Tuberkulos
- Översiktligt om mykobakterier
- Patogenes
- Virulens
- Diagnos
- Behandling
- Resistensutveckling
- Vaccin
Fallrelaterat
Veckomål
Tuberkulos och övriga mykobakterier
Global förekomst, vad kännetecknar mykobakterier, patogenes, mekanismer vid infektion, riskfaktorer att utveckla aktiv tuberkulos (jmf latent), skillnader mellan primär och sekundär (postprimär) tuberkulos, immunitet mot intracellulära infektioner, vaccin (BCG och framtida) diagnos (PPD, IGRA, PCR, röntgen, bakteriologisk odling), smittspårning.
Repetera malaria (se kursvecka 4 parasitologi)
HIV/HTLV (fallföreläsning)
Retrovirusgruppen – egenskaper, geografisk utbredning, smittvägar, hur virus tar sig in i celler (replikation och variabilitet), immunsvar, tidsförlopp, kronisk infektion, behandling, resistensutveckling och ev vaccin. Tumörimmunologi (vid nedsatt immunförsvar).
CNS infektioner
Meningit och encefalit. Bakteriella och virala. Bakteriell meningit (purulent), virusmeningit (serös) och encefalit. Behandling.
Bakteriella ex Haemophilus influenzae, Streptococcus pneumoniae och Neisseria meningitidis; immunitet och vaccination, septisk chock vid meningokockmeningit. Mindre vanliga ex borrelia, E. coli, Grupp B streptokocker, Listeria och M. tuberculosis.
Virala ex herpesvirus (HSV), parotitvirus, morbillivirus, Enterovirus (poliovirus, echovirus, coxackievirus), TBE-virus, JC virus, rabies. Övriga är prionsjukdomar, Toxoplasma (parasit) samt Cryptococcus (svamp).
Viktigt
Detta är som man MÅSTE kunna till tentan.
Sammanfattning
Retrovirus
Retrovirus använder sig av enzymet omvänt transskriptas (RT) för att omvandla sitt RNA till DNA. Detta DNA kan sedan integreras med värdcellens egna. Detta RT gör dock fel ibland, vilket ger att virusen är genetiskt variabla. Dessa virus kan orsaka cancer om de integrerar sitt DNA nära onko eller supressor-gener och då stör eller ökar deras uttryck.
Det är komplexa virus och alla innehåller regulatoriska funktioner som gag-, pol- och env- gener. Lentivirus skiljer sig från andra genom att de kan infektera celler som inte delar sig (som makrofager), som har intakt kärnmembran.
HIV - Human immunodeficiencyVirus
Är ett Retrovirus inom familjen Lentivirus.
Struktur
HIV viruset är ett virus med hölje. Detta hölje har viralt kodande proteiner TM (Transmembrane, gp41) och SU (gp120), där TM-SU komplexet är ett receptorbindande utskott och TM är ett fussionprotein. På insida av höljet finns Matrixprotein (MA, p17). Kapsiden består av kapsidprotein (CP, p24). I kapsiden finner man sedan Nukleinsyra, Nukleokapsidproteiner (NC), omvänt transkriptas (RT), Proteas (PR) och Integras (IN).
Arvsmassan består av 2st +RNA, som är förenade i 5' ände med hjälp av NC. Den är i formen RNA när den befinner sig i viruspartikel och av formen DNA i cellen. De skiljer sig i sina LTR (Long Terminal Repeat) områden vid ändarna. De tre gemensamma delarna för retrovirus (gag, pol, env) kodar för;
- Gag: Matrixprotein, Kapsidprotein, Nukleokapsidproteiner
- Pol: Proteas, Omvänt Transkriptas, Rnase H och Integras
- Env: Höljeproteinerna SU och TM.
HIV Livscykel
Receptorbindning och fusion
- HIV binder till CD4- receptorn (T-celler, Monocyter och Makrofager) med gp120.
- Bindning ger konformationsändring hos SU-TM komplexet
Komplex del som gör att viruset gömmer döljer protein från immunförsvaret. SU ligger i en dold fick som inte är tillgänglig för antikroppar. Inbindning exponerar denna.
- Viruset kan nu binda till kemokinreceptorer (CCR5 och CXCR4 främst) med ytterligare gp120, detta krävs för att kunna komma in i cellen.
CCR5 finns på T-celler makrofager, monocyter och dendritiska celler medan CXCR4 finns på T-celler.
Detta gör en andra konformationsändring som leder till att fusionspeptiden TM exponerad och sticks in i cellens membran.
- En por öppnas mellan cell och virus, vilket gör att Kapsiden kan ta sig in i cellen och kläs av.
Omvänd transkription
För att utföra detta steg använder viruset enzymen RT och RNasH och det utförs i cytoplasman inutti den delvis avklädda kapsiden.
RNA molekylerna kommer transkriberas till komplementära DNA (cDNA) genom RT (cellerna har ingen sådan funktion). RNaseH degraderar RNA mallen så DNA kan bildas.
Under processen förlängs LTR regionerna och det är även här som den stora variationen uppstår hos HIV, pga den höga mutationshastigheten.
Integration
DNA-syntesen avslutas och det transporteras av viruset till cellkärnan i ett "preintegrationskomplex", där även andra viktiga proteiner ingår. Som sagt kan dessa typer av virus även infektera icke delande celler. Detta beror på just preintegrationskomplexet (MA, IN, Vpr) innehåller signal för transport till cellkärna.
Inne i kärnan integreras virusets DNA i kromosomer med hjälp av Integraset (IN) genom att klippa in sig i värdcellens. Integrationsplatsen är utvald i princip slumpmässigt, men generellt ett aktivt transkriberat område.
Virus DNA:et som integreras kallas Provirus och fungerar i princip som en vanlig gen i vårt DNA. Integrationen gör att cellen blir infekterad tills den dör och även att det ärvs till dotterceller. Utåt finns där inte något som avslöjar att cellen är infekterad, vilket skyddar mot immunförsvaret, om viruset är inaktivt och inte producerar sina proteiner.
Produktion av nya virus
Normalt påbörjas produktion av nya virus direkt efter infektionen av cellen, men kan även lägga sig latent vilande under lång tid.
Det virala RNA bildas från provirus DNA-mallen av cellens egna Polymeras. Detta mRNA får samma form som cellens egna RNA, med Poly-A-svans. Detta mRNA fungerar sedan både som grund till nya virus och även för produktion av virus proteiner.
Dessa förpackas sedan och flyttar ut mot cellmembranet för att kunna omslutas och få ett nytt hölje, samt lämna cellen. Väl utanför cellen mognar viruset till HIV.
HIVs uttryck av proteiner
HIV kan uttrycka många proteiner på liten arvsmassa beroende på flera orsaker;
- Krävs bara en promotor med ett primärt RNA-transskript
- Alternativ Splicing av RNA transkript
- Flera (3) överlappande läsramar
- mRNA ger flera protein
- Prekursorproteiner (Gag, Gag-Pol och Env) som kan klyvas till funktionella protein
- Protein kan ha flera funktion
Patogenes
Troligen är det CD4+ T-celler som är viktigast för patogenes, dess celltropoism. Detta leder till bortfall av T-cellerna och försämrat immunförsvar. Detta i sin tur ger opportunistiska infektioner och tumörer, vilket är det man kallar immunbristsyndrom (AIDS). Utan behandling (antiviral) dör man oftast inom 10 år, 2 år efter AIDS uppkommit.
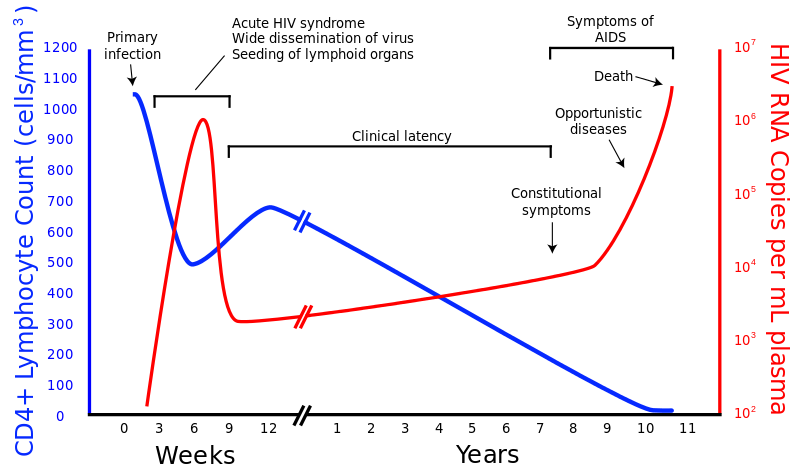
Primärinfektion
Smittar direkt genom slemhinna vid könet eller anus och viruset tar sig då ner till CD4+ celler. Dendritiska celler kan vara en vektor där viruset färdas genom för att nå T-cellerna.
Inom några dagar har HIV spridits till lymfatiska organ för att snabb replikera sig, och genom viremi tagit sig till kroppens alla lymfatiska organ (inkluderande mikroglia i hjärnan). Viruset når sin toppkoncentration efter ca 3 veckor, och därefter sjunker ner igen, troligen beroende på det medfödda immunförsvaret (Defensiner, Interferoner), men även Cytotoxiska T-celler och Antikroppar från Plasmaceller.
Månader efter primära infektionen insätter sig "viral set-point" (semistabil virusnivå). Vilken nivå den stannar på är viktig då det korrelerar till hur fort man utvecklar AIDS. Under den stabila fasen upplever man sällan några problem.
AIDS - Acquired immunodeficiency syndrome
När (snitt 10 år vid obehandlad) nivåerna av CD4+ celler har sjunkit tillräckligt mycket når man det stadie som kallas AIDS. Då har immunförsvaret sjunkit så man får symtom och opportunistiska infektioner och tumörer kan börja ske. Hit några nästan alla, men olika snabbt. Når man under 200 T-celler per mikroliter blod är man under en kritisk nivå.
Cancer uppstår eftersom immunförsvaret förlorar sin förmåga att ta hand om felaktiga celler (NK-celler t.ex.).
T-Hjälparceller bidrar normalt till;
- Aktiverar T-celler och stimulerar dem att bli Cytotoxiska T-celler
- Aktiverar B-celler till att bli Plasmaceller och producera antikroppar
Undvika immunförsvaret
- Genetisk variation:
- Stor variation och snabb evolution orsakat av RT-enzymet misstag. RT saknar korrekturläsning vid cDNA syntes.
- Rekombination då viruset har 2 RNA-kopior som kan rekombineras med andra virus och dela med sig av gynnsamma gener. HIV är enda virus med diploid RNA-nukleinsyra.
- Fly undan: Variationen i gener gör det svårare för antikroppar och cytotoxiska T-celler att angripa. Dessutom är ytterhöljets protein (SU) utformat för att undvika antikroppar. Immunförsvaret hinner alltså inte med förändringarna.
- Nedreglering av immunförsvar: Vif medför en nedreglering av t.ex. APOBEC-protein som försvara oss mott virus. Nef medför nedreglering av HLA-1 (MHC-1) och försvårar Cytotoxisk T-cells svar.
- Virusreservoarer: Gömma sig i vilande T-hjälpar-celler (CD4+), där de integrerar sitt DNA och då inga virusprotein uttryck. Dessa celler lever därför länge och dödas inte av immunförsvaret.
Det finns det flera olika typer av HIV; HIV-1/2 och subgrupper till dessa. HIV-1 står för pandemin (till 95%) och ger högre nivåer i blod och kroppsvätskor (därför mer smittsam också). HIV-1 är därför också mer virulent och leder snabbare till AIDS.
Varför dör immuncellerna?
Bara 5-10% av de celler som dör är faktiskt infekterade av HIV, de resterande är inte smittade.
T-cellerna som är infekterade kommer dö på grund av virusets aktivitet dödar dem eller för att immunförsvaret reagerar på att de är infekterade och dödar dem.
Upptäcker cellens försvar mot främmande DNA (Ifi16) kommer den skapa en kaskad av inflammatoriskt respons och tillslut döda sig själv (Pyroptos).
När Integras ska koppla ihop HIV DNA med vårt egna har cellen ett system som upptäcker ett brott på DNA strängen. Detta leder då till Apoptos.
Andra exempel kan vara CD8+ celler som upptäcker via MHC att cell är infekterad eller HIV proteas råkar klyva de interna Caspaser och triggar då igen apoptos.
Vid en infektion kommer T-celler finnas i lymfonder och HIV att färdas till lymfnoderna. I lymfnoden kommer HIV att infektera några CD4+ celler. Någon av dessa kommer att trigga Pyroptos genom de mekanismer som beskrevs ovan. IL-2B kommer då att läcka ut ur celler (inflammatoriska) och signalera till granncellerna. Detta leder till att granncellerna också genomgår Pyroptos och en kedjeeffekt startar. Detta är också varför man får stora lymfsvullnader vid primärinfektion och en kronisk inflammation.
Det är alltså inte apoptos hos infekterade celler som orsakar den stora celldöden hos CD4+ celler.
Epidemiologi
UNAIDS räknade 2013 att det fanns ungefär 35 miljoner smittade och att ytterligare 2.1 miljoner smittades per år. Fler miljoner har dött av infektionen och ytterligare någon ytterligare varje år. Förekomsten är som störst i södra Afrika. Asien och Östeuropa har ett snabbt ökande antal. I Sverige rör det sig om 1000-tal. Antiviral kombinationsbehandling har kraftigt förbättrat prognosen för HIV patienter.
Spridning
De infekterade bär på viruset i vätska, som blod, sperma, modersmjölk och slidsekret. Det är avgörande hur stor mängd virus man får i sig, varför det spelar roll både typ av smitta och hur stor koncentration bäraren har. Vanliga smittvägar är;
- Sexuell kontakt
- Drogmissbruk där man delar sprutor
- Mor till barn vid födsel eller amning
Diagnostik
Mäter HIV-1 p24 antigener I blodet. Man gör först en ELISA test och sedan Western Blot (elfores). CRP med RNA i blod kan göras tidigt och säkert.
Prevention och behandling
Man mäter p24 protein antikroppar och proteinmängd i blodet. P24 är en del av kapsiden hos HIV och kan mätas redan efter 2 veckor från smitta.
På grund av sin ständiga förändring finns där i dag inget vaccin för HIV, vilket gör att prevention (kondom) blir rekommendationen för att undvika smitta. Antiviralt medel kan använda profylaktiskt. Mödrar med smittan som tar behandling minskar risken för smitta till under 1% om den går på behandling. Blir man stucken under vården används även postexponeringsprofylax.
Har man en fungerande antiviral behandling, så att plasmanivåerna för viruset sjunker, är risken för smitta vid HIV minimal eller till och med försumbar.
Det finns numera många läkemedel mot HIV och dessa är då antivirala kombinationsbehandlingar. Sedan dessa har mortaliteten minskar kraftigt för de som går på behandling. De fyra klasser som ingår i kombinationsbehandling är i princip;
- Hämma RT enzymet genom Nukleosid och Nukleotid-analoger
- HIV proteas-hämmare.
- Inträdeshämmare
- Integrashämmare
Vissa har en mutation på CCR5 receptorn som gp120 måste binda in till för att kunna komma in i flera av immunförsvarets celler. Detta ger en immunitet mot HIV.
Man får tänka på att om man ska testa ett barn under 6 månader måste man göra det genom PCR amplikation av DNA/RNA. Screening med antikroppar fungerar inte eftersom moderns antikroppar kommer finnas hos barnet upp till en viss ålder. Därför blir svaret garanterat positivt om modern har HIV även om barnet inte fått det.
Deltaretrovirus - HTLV
Upptäcktes runt 1980 och är hittills ända virus som är direkt orsak till cancer hos människan. Precis som HIV infekterar den CD4+ T-celler (Hjälpar T-celler). De använder dock olika receptorer (GLUT-1).
HTLV orsakar Adult T-Cells leukemi (ATL) hos upp till 5% av de som smittas under barndomen av bröstmjölk. Det är dock en ovanlig sjukdom i Sverige med några få fall då och då. Sjukdomen ATL har hög dödlighet, är svårbehandlad och uppträder runt 40-60 års ålder.
Det som händer är att viruset får T-cellerna att ohämmat dela sig. Blir man smittad i vuxen ålder kan det istället leda till nervskador med förlamning. Livstidsrisken om man får smitta via bröstmjölken är 4%.
Det finns olika typer (HTLV-1 till 4) och de skiljer sig i hur allvarliga (eller ingen) infektion de ger, där då HTLV-1 är värst.
Struktur
Dess genetiska struktur liknar HIV med Gag, Pol, Proteaser, integraser, omvänt transkriptas osv. LTR finns i båda ändarna och en region som kallas X.
Region X kodar för Tax (Transaktiverande protein från Region X). Denna stimulerar transkription men ligger utanför DNA promotors.
Replikationen
Fungerar som andra retrovirus men stimulerar dessutom värdcellen (Th-celler) att dela sig. HIV inducerar istället förstörelse. Viruset kopieras vid celldelning ihop med att cellen utför sin vanliga delning, detta gör även att viruset är mer stabilt.
Patogenes
Tax gör att IL-2 receptorer ökar och därmed även stimulansen av IL-2 till Th-cellerna. IL-2 är en interleukin som stimulerar celldelning. Men Tax påverkar även andra delar som leder till mer celldelning.
Epidemiologi
Vanligast i Afrika, japan och Sydamerika.
Prevention
Man undviker spridning genom att testa kroppsvätskor som doneras (blod, bröstmjölk, organ), men även att mödrar inte ammar sina barn. Smittan kan spridas sexuellt och skyddas då med kondom.
Det finns inget antiviralt medel eller vaccin mot infektionen.
Mycobakterier och Tuberkulos
Mycobakterier generellt
Syrafasta stavar, en visuell beskrivning att de behöll färgning även om man behandla med syra. Bygger på att cellväggen är lipidrik, Mykolsyra (ger ett vaxliknande membran). Det är det fettrika membranet som gör att de är syra-fasta och färgas röda när Ziehl-Neelsen färgning används. Bakterierna räknas som Grampositiva även om de inte går att färga på grund av sitt tjocka lipidlager.
De kan delas in efter växthastigheter (kliniskt). De är normalt inte så snabba på att växa i relation till andra bakterier, men de snabbväxande kan behandlas mer likt de Grampositiva släktingarna.
MAC - Komplex
Ett komplex är en grupp som likar varandra väldigt mycket och svåra att skilja på lab och ger samma symptom. Därför kan man benämna det som ”MAC”-komplex (M. Avhumanisera Intracelluare).
MAC drabbas både barn och vuxna, varpå barn då för att de har outvecklat immunförsvar och får svullen lymfa vid halsen. Vuxna kräver lång antibiotikabehandling (1år) och om inte immunförsvaret återställs kommer man få det igen.
Opportunister
En strikt opportunist ska i princip bara ge sjukdom när man har immunbrist. De är alltså inte smittsamma till folk som har normalt skydd.
Marinum
Drabbar främst akvarieägare och man har sår. Skadar lederna och går på djupet om det inte behandlas
Leprae - Spetälska
Svårstuderad då den inte går att odla utan levande värd.
Tuberculoid:
Immunförsvaret orsakar skadorna
- Få bakterier (Paucibacillär)
- Förlora pigment (Hypopigmenetering)
- Känselbortfall
- Th1 svar
Lepromatous:
Grov hud med groteskt utseende
- Multibacillär
- Noduli
- Förtjockad hud
- Nervengagemang kommer senare
- Th2
Virulensfaktorer
- Tillväxt och överlevnad intracellulärt => undvika immunförsvar och utlösa patologiskt immunsvar
- Lipidrik cellvägg med antigena och biologiskt aktiva strukturer
Standardbehandling
HAART (Högaktiv Antiretroviral behandling eller Highly Active Antiretroviral Therapy).
Rifampicin: Inhibera RNApolymeras
Isoniazid: Inhibera mykolsyra syntes
Etamubutol: Påverkar RNA syntes
Pyrazinamid: Okänd mekanisk, sänker pH?
Det är främst på grund av resistensutveckling man behandlar med minst 3 olika preparat samtidigt.
Tuberkulos
MTB-komplexet orsakar sjukdomen Tuberkulos, men m. Tuberculosis är främsta orsaken (över 90 %). Bakterien är strikt aerob och mycket långsamt växande. Smitta sker oftast via luftburen smitta där man får i sig bakterierna. Bakterien tål intorkning och kan därför leva långa perioder i uttorkat sputum eller damm. Bakterien har dock problem med värme som pastörisering och UV/solljus.
- M. Tuberculosis: Står för nästan alla fallen.
- M. Bovis: Boskap, kan sprida från kor till människa vid opastöriserad mjölk och ge infektion i tarm.
- M. Bovis BCG: Vaccination, ger er tbc.
- M. Africanum:
TBC är både opportunist och primär infektion. Risken att smittas av TBC är mycket högre om man har nedsatt immunförsvar.
Ungefär 1/3 (2 miljarder) av jordens befolkning är infekterade med TBC och dödsfallen minskar även om MDR-TB (multiresistent) ökar. Tuberkulos är den största dödsorsaken senaste 200 åren med 1 miljard personer. 90% av de smittade är dock inte medvetna om sin infektion eftersom det lägger sig latent.
De flesta fall som uppkommer hos svenskfödda är personer som är över 65 år och blivit smittade under första halvan av 1900-talet.
Primär infektion
Det typiska är att någon hostar och man andas in det, oftast i höger lunga rent anatomiskt.
Man får en inkapsling bestående av Langhans cells (sammansmälta makrofager, polynukleära) och i mitten en ”ostig nekros”. I osten finns fria bakterier medan då i Langerhans inuti i cellerna. Denna inkapsling stänger in bakterierna och man behöver aldrig bli sjuk.
Antingen får man sedan en persisterande eller reaktiverad infektion. Har man haft en inkapsling kan det öppna sig när immunförsvaret sänks vid t.ex. hög ålder. Vid reaktivering kan man få en lokal infektion eller där det sprider sig till andra delar av kroppen.
En nyckel för att bakterien ska överleva är att den lever i makrofagerna. TBC bakterierna påverkar signalkaskader och därför slås inte Lysosome och Fagosome ihop. Bakterien kan därför bo kvar i Fagosomen som latent infektion och dela sig. Detta sker genom att bakterierna producerar ett protein som hindrar fusionen.
Processen är dock delvis reversibel när vi börjar producera INF-y och TNF-a som då tvingar ihop Lysosome och Fagosome . Då dödar man av det i makrofagerna och det ”ostiga” finns kvar med virus som kan bryta ut senare.
Organ som drabbas kan vara lokalt eller Militar där det sprider sig lite överallt.
Sjukdomen i sig beror på kraftigt immunsvar och det är T-celler (CD4+ och CD8+), makrofager och dendritiska celler som är viktiga. Så länge dessa delar fungera hålls oftast infektionen på plats.
När bakterien lägger sig latent sänker den sin ämnesomsättning och replikationshastighet, och överlever då i granulomen (tuberkler).
Den primära infektionen brukar tillbakabildas men kan lämna rester i form av förkalkning.
Virulensfaktorer
Bakterien saknar toxin men orsakar genom överdriver långvarig inflammation celldöd och vävnadsskada. Detta beror bland annat på Cord Factor (cellväggslipider).
Bakterien kan både undvika och dämpa immunförsvaret, vilket den behöver fram tills den är inkapslad i Granulom. Detta sker genom hämma MHC-2 uppreglering hos makrofager, samt nedreglering av proinflammatoriska cytokiner. Nedreglering av cytokiner förhindrar uppkomst av specifika T-celler.
Lungtuberkulos
Liknar lungcancer.
- Persistent hosta
- Viktnedgång
- Nattliga svettningar
- Trötthet
Extrapulmonär TB
Beror på vilket organ som är påverkat och kallas (som några andra) ”the great imitator”. Den kan då sätter sig som vanligast i ben eller hjärnhinnor (meningit).
Infektionsstadier
En primär infektion kan ta tre vägar;
- Läka ut
- Lägga sig latent
- Bli progressiv
Sekundär infektion kan komma av att man varit läkt men blir infekterad igen eller genom aktivering av latent infektion. Sedan kan det leda till;
- Läka ut
- Lokaliserad
- Progressiv
Blir man smittad av m. Bovia istället kommer primärinfektionen att hamna i magar-tarm-kanalen eftersom man får i sig bakterierna via maten istället för luften (lungorna.
Granulom förhindrar förökning och avgränsar bakterier; försköning kräver syre. Detta bildas då immunförsvaret omringar bakterierna och bildar nekrotisk vävnad. Detta kan sedan övergå till fibros och calcification (Ranke Complex).
När makrofager aktiverar T-celler genom MHC-2 och T-cells receptor ihop med IL-12 kommer Th1 celler kunna producera INF-y som tvingar ihop fagolysosomerna och bakterien kan förstöras.
Förändringar i lunga kallas Ghon-fokus.
Förändring i lymfkörtlar ihop med lungorna är ett Ghon-Komplex
Sekundär TBC
Efter primära infektionen finns Th-minnesceller. Detta gör att immunförsvaret kan öka och bli kraftigare när infektionen blommar ut igen. Detta leder dock också till kraftigare vävnadsdestruktion. Den kliniska symptomen är diffus.
Vid ålder eller HIV kan spridningen ta fart igen genom att Ghon Focus (ostarna) inte längre kan hålla kvar bakterierna. De färdas då helst ut till övre loben i lungorna (mest syre?) och koloniserar där flera platser. T-minnesceller släpper ut cytokiner och svaret blir kraftigare och därför bildas mer nekrotisk vävnad och kaviteter. När detta bildas kan även TBC spridas till andra delar av kroppen genom håligheterna.
Progressiv TBC
Kan man få både vid primär och sekundär TBC och sker främst vid immunbrist. Då kan det sprida sig genom blod till flera organ eller till hela lungor.
Hematogen spridning
Kan drabba alla organ som; hjärnhinnor, lever, mjälte, benmärg, njurar osv.
T-cells mediterad hypersensiterinsinfektion, därför tar det lite längre tid för att ge reaktionen. Men vid sekundär finns minnes-celler som kan aktiveras. Det är kroppens immunförsvar som destruerar genom granulom.
Smitta
Främst blir man smittad utomlands eftersom det knappt finns i Sverige. De smittar via luften om det är lungorna och inte om det är TBC i andra delar av kropp.
Använder man medicin som sänker immunförsvar kan TBC blomma ut och det gäller t.ex. medel med TNF-a blockerare.
De som inte är smittsamma är
- Latenta fall
- Behandlade fall
- Extrapulmonär
Somalia är det land där störst mängd kommer TBC fall kommer till Sverige (överlägset). Risken att smittas är då högre för utlandsfödda, sjunker till hälften för andra generationens invandrare och sedan går den ner till Svenska nivåer med infödda.
Med mer resistens får man gå längre ner mot andra läkemedel och i sista fall möjligen kirurgi.
Diagnostik
Mikroskopering och odling behövs för att göra resistensbedömning. Man tar provet från det ställe där man tror att smittan sitter. Odling är svår att göra och kan behöva göra många tagningar. Normalt är 3x provtagning för att odla och ibland måste man göra om proceduren flera gånger med att ta morgon-sputum flera dagar.
Mikroskopering är snabbt och enkelt att göra då man slår ihjäl andra bakterier och kollar efter mycobakterierna. Man kan dock inte artbestämma här.
Odling behövs för art och resistensbestämning, tar 10-40 dagar.
Kör man PCR Kan man få fram MTB men inte om det är BCG eller allvarligt.
Resistensbestämning är svårt då de växer svårt och känsliga. Man måste ha mängder med kontrollfunktioner. Beskrivna brytpunkter gör även att man kan markera resistens när det kanske inte finns.
Hybridisering är när man resistensbestämning via generna istället för via prov. Kan man med PCR ta fram sekvenser och se hur man kan behandla.Detta tar då 1 dygn för att ta fram istället.
Latens TB
Har man latent kan man mätande PPD test (prov i huden), Lungröntgen eller IGRA-test.
PPD ger en typ 4 överkänslighet, som då dröjer 2-3 dagar och cellmedierad. Typ 1-3 och 5 är antikroppsmedierade.
IGRA Triggar TB-specifika cellulärt minne och TH-1 minnesceller sparkar igång IFN-y produktion som går att mäta via blodprov.
Tuberkulin är en blandning av flera Mycobakterier och därför inte specifik. Antigen som ingår i IGRA mäter motspecifika antikroppar.
Vaccinationer och behandling
Numera finns inga rekommendationer av vaccinationer hos vuxna eftersom det inte är bevisat effektivt. Barn skyddas ungefär till 15 års ålder och ger lindrigare förlopp. Man använder BCG.
Sjukdomen har en obligatorisk behandling, vilket gör att man får låsa in folk tills de tar sin behandling (eftersom man inte kan tvinga folk att ta behandlingen). Det är en anmälningspliktig sjukdom.
Kombinationsbehandling med 3-4 antibiotika under 2 månader, därefter kan man avsluta 2 av dem och fortsätta med resterande 2 under 4 resterande månader. Alltså 6 månader totalt. Man ska vara mikroskopinegativ för att övergå ner till 2. Man måste ha flera för att undvika resistens.
Vid latent sjukdom kan man behandla i 6-9 månader och ett antibiotikum. Beror på att man har få bakterier och celldelningar. Låg risk för mutation och liten risk för mutation.
MDR TB är Multiresistent och XDR Extensiv Multiresistens. Kör man kombination är det egentligen ingen risk för resistensutveckling. Resistens utvecklas där man har undermålig behandling (Ryssland t.ex.). Därför kan områden ha stor andel resistent i de nya fallen.
Problemet är att Rifampicin och Isoniazid är standardbehandlingen, grunden, och denna blir då resistent vid MDR. Har man XDR försvinner då även några av de andra preparaten. Då har man läkemedel i kategori ”rävgift” kvar, vilket är svåra att behandla länge (som då krävs) med tanke på biverkningar.
Nysmitta - När man letar?
Tittar på hem och arbetsplatser. Högriskpatienter screenas innan behandlingar, som t.ex. cancer. Folk från utsatta länder screenas också
HIV och TBC
Största orsaken till död hos HIV-Positiva. Risken att utveckla aktiv TB är 10% / år. De drabbar områden som har hög nivå av TB också hög nivå HIV.
Alltså kan man se att TB ökar i de länder där HIV finns och ökar. De med HIV ökar mängden aktiva TB fall och då smittar dessa även de som är immunokompetenta. HIV och AIDS ökar mottagligheten och spridningsrisken för TBC.
Kombinationsbehandling av båda samtidigt är svårt eftersom man behöver 3-4 läkemedel per sjukdom.
IRIS är när man behandlar med antiviralt och ökar CD4+ celler när man behandlar HIV. När immunförsvaret varit nere har TB växt till sig. Immunförsvaret kommer attackera TB när det ökar och leder till explosion av sjukdomen med stora accesser, man måste därför behandla TB innan HIV.
Icke-tuberkulösa mycobakterier
Dessa räknas som mycobakterier som inte är inblandade i M. Tuberculosis-komplexet eller M-leprae. De ger liknande tuberkulös-symptom och finns i miljön. Oftast uppkommer de hos patienter med underliggande lungsjukdom eller immundefekt. MAC-komplexet som nämndes tidigare är vanligaste orsaken till svår infektion vid AIDS.
Dessa bakterier är inte lika virulenta, vilket märks på att de främst dyker upp hos personer med lågt immunförsvar. De gömmer sig alla inuti celler och ger en fördröjs överkänslighetsreaktion.
Malaria - Plasmodium Vivax
Malaria ingår i underavdelningen Hemosporina och tillhör släktet Plasmodium. I Sverige anmält 100-150 fall per år och är anmälningspliktig.
Finns flera typer i Plasmodium sälktet:
- P. Falciparum (den stora i dödsfall) - dödligast och mest aggressiv.
- P. Knowlesi (apmalaria egentligen)
- P. Vivax - Vanligast
- P. Ovale
- P. Malarieae (mildaste, går att ha 20-30år)
Många parasiter är vektorburna och med Malaria är det myggan Anopheles som gäller. Denna myggan finns i större delen av Sverige redan, men bär då inte på parasiten (än).
Livscykeln är att myggan kommer och ska suga blod av en värd. De sprutar då in saliv och samtidigt då Sporozoiter. De tar sig då till levern (Hepatocytreceptor för Trombospondin). De växer till sig och bildar då en Schizont (påse) med Merozoiter i. När levercellen är full kommer den spricka och släppa ut 40,000 ur varje och infekterar då nya blodkroppar. När de binder in växer de till sig och blir Trophozoites (tillväxande och delande formen). Blir en ny Schizonts och går sedan ut i blodet igen.
P. Vivaxo ch P.Ovale kan vara fästa till retikulocyter medan P.Falciparum kan invadera röda blodkroppar av alla åldrar. Detta gör att Falciparum kan ge kraftigare anemi,
Några blir Gametocyter som finns i både hane och hon, som hos myggan sen kan para sig igen och bilda nya.
Kan snabbt leda till anemi. Febertoppar kommer när cellerna spricker och de mer aggressiva varianter har konstant "poppning". Vivax och Ovale har "varannan dag feber". Den mildare (Malariae) är mer var tredje dag feber. Detta beror på tillväxttiden inne i cellerna är just 2-3 dagar och detta sker relativt synkroniserat.
Återkommande feber kan komma från Vivax och Ovale och dessa är de som kan ge återfall av malaria då de kan ligga vilande i levern. Dessa kan vara vilade under månader till år efter primärinfektionen för att sedan sprida sig till blodet och orsakar sjukdomsåterfalll.
Patogenes
Feber är vanligast symtomet och kommer vid "poppande" (erytrocyter går sönder). Det är Glykolyserade lipider i parasiten som stimulerar att bland annat TNF-a frisätts. Detta påverkar direkt temperaturcentrum.
Andra vanliga allmänna symptom kan vara; huvudvärk, illamående, kräkning och diarré ,vilket då likar en viros. P. Falciparum kan istället likna vid sepsis med sin kraftigare systemiska påverkan. Hela immunförsvaret är igång under infektionen och man kan få blodvärden/anemi ner mot 50g/l.
Vid svår Malaria kan man få sänkt medvetande. Detta beror på att infekterade röda blodkroppar binder till kärlväggar (cytoadherence) och andra friska blodkroppar (rosettbildning) i små kapillära venoler. Då blir syresättningen och glykostransport lidande. Kan då ge funktionsstörning i hjärnan när den inte får vad som behövs.
Man kan i röda blodkroppar se Maurers clefts; proteiner som tillverkats av P. Falciparum. Det syns som små röda korn. Dessas protein är adhesiva och bidrar till bindningen beskriven ovan. Tanken för parasit är att undvika passage genom mjälte och därmed bli förstörd.
Vivax använder "Duffy receptor" för att ta sig in i blodcellerna.
Blodgrupp spelar roll för hur allvarligt man drabbas och Blodgrupp A är vanligare vid svår malaria medan Grupp 0 och sickel-cell (ingen Duffy) m.f kan ge skydd mot dödlig malaria. Detta har gjort att andelen med dessa skyddande defekter ökar i viss områden där Malaria är.
Olika arter av myggan (Anopheles) har olika förmåga att överföra parasiten.
Cerebral malaria
Vanligaste dödsorsaken bland barn av malaria (80%). Vad man vet är att det bara är Falciparum som orsakar det. Klarar man sig når man något som kan kallas klinisk immunitet som gör att malarian ligger på en sparlåga.
Patienterna har högt TNF-alfa, ju högre desto svårare sjukdom. Det gör att ICAM-1 upp regleras och kärlen täpper igen.
Diagnostik
Det är under tidigt stadie som diagnos och behandling måste sättas in för att rädda liv. Man påvisar smittan genom kapillärprov som sedan mikroskoperas ("tjock droppe"). Då kan man se art och andel infekterade celler.
Det finns numera även ett snabbtest "dip-stick-diagnostik" som upptäcker specifika antigen.
Malaria ska alltid uteslutas vid oklar feber (med och utan organsymptom) om person varit i Malariaområde. P. Falciparim är starka kandidaten om besöket var under en månad sedan eller om patienten är svårt påverkad.
Prevention och behandling
Myggorna (honor) biter på natten, så man ska ha insektsdränkta myggnät för att skydda sig.
Man ger samma medel som profylax som för att hjälpa när man fått infektion. Klorokin och Artemisinpreparat är det vanliga ihop med andra läkemedel. Det finns en ökad resistens mot läkemedel och insektsgift. Man kan få bort Malarian med behandling men det kan även hända att det återuppstår om några parasiter legat vilandes i levern.
Profylaktiskt kan man ge behandling som dödar av Sporozoiter innan de infekterar leverns hepatocyter. Det gers normalt till resande.
Finns förfarande inget fungerande vaccin då parasiten ändrar sina antigen. Framställning hämmas av att Malaria främst drabbar fattiga och därför inte finns ekonomiskt incitament.
Personer som bor i områden med Malaria och som lever med det blir efter ett tag immuna. Flyttar de dock iväg en tid och sedan tillbaka, förloras denna immunitet. Nyfödda barn är skyddade av moderns antikroppar under de första månaderna och överlever de till några år, kommer de själva börja bilda.